Concetti Chiave
- La scoperta dell'elettrone ha cambiato la concezione dell'atomo da entità indivisibile a struttura con carica positiva e negativa.
- Rutherford ha introdotto un modello atomico con un nucleo positivo e elettroni orbitanti, ma con problemi legati all'emissione di radiazioni.
- Bohr ha sviluppato un modello in cui gli elettroni abitano livelli energetici specifici, emettendo fotoni quando saltano tra questi livelli.
- Il modello di Bohr è stato fondamentale per comprendere le linee spettrali dell'idrogeno e la classificazione delle stelle.
- La classificazione stellare si basa sulla temperatura superficiale e sulle linee spettrali, con il Sole classificato come una stella di tipo G2.
In passato gli studiosi avevano idee molto vaghe sulla struttura dell'atomo. Dapprima i fisici pensavano che gli atomi fossero singole entità indivisibili. Poi, con la scoperta dell'elettrone, si seppe che ciò era falso. Ma se un atomo conteneva un elettrone con una carica negativa, doveva contenere anche una carica positiva per controbilanciare la prima, visto che si sapeva che gli atomi erano elettricamente neutri.
modello di Rutherfor d modello di Thomson
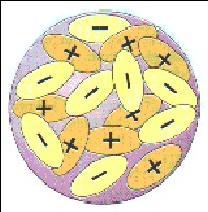
J. J. Thomson, l'uomo che scoprì l'elettrone, pensava che elettroni e protoni fossero impacchettati insieme come l'uva passa nel panettone.
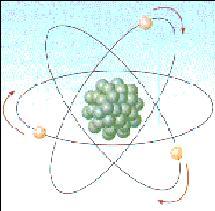
Ernest Rutherford demolì questa teoria quando scoprì che l'atomo in gran parte è vuoto e introdusse la teoria secodo la quale gli elettroni giravano intorno al nucleo (che aveva carica positiva) come i pianeti intorno al Sole.
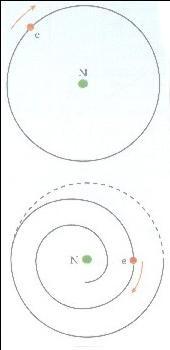 |
Questa teoria presentava però un problema. Come sapete quando una particella si muove lungo un'orbita circolare subisce un'accelerazione verso il centro del cerchio: l'accelerazione centripeta. E quando un elettrone viene accelerato, emette radiazioni elettromagnetiche o luce. Per la tesi della conservazione dell'energia, l'energia di questa luce deve provenire dall'energia necessaria a percorrere l'orbita, così l'orbita dell'elettrone dovrebbe restringersi fino a cadere sul nucleo. |
Niels Bohr si unì al gruppo di Rutherford e fece due cose sorprendenti. Provò a mettere insieme la teoria atomica con la teoria quantistica della luce di Einstein, e decise di agire supponendo che le leggi dell'elettromagnetismo non valessero all'interno dell'atomo. Cioè egli pensò di lavorare con il modello planetario degli elettroni orbitanti intorno al nucleo, che sembrava al momento la cosa più sensata.
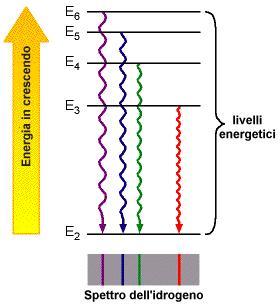
Bohr suppose che gli elettroni non emettano luce quando ruotano intorno al nucleo. Ma quand'è che emettono luce? Bene, qui ci si potrebbe rifare sullo spettro osservato per l'atomo di idrogeno. Si sapeva che gli atomi di idrogeno emettono quattro lunghezze d'onda sul visibile: rossa a 6660 Angstrom (un Angstrom equivale a 10 -10 metri), verde a 4860 A, blu a 4340 A e violetta a 4100 A.
Mettendo tutto questo insieme, Bohr postulò che gli elettroni in un atomo hanno specifici livelli di energia nei quali possono stare, e quando saltano da un livello più alto ad un livello più basso emettono un fotone di energia pari alla differenza tra le energie necessarie a percorrere le due orbite. (Una logica estensione di questo è che, per poter saltare ad un livello energetico più alto, gli elettroni devono assorbire fotoni di energia pari all'energia che compete a quell'orbita).
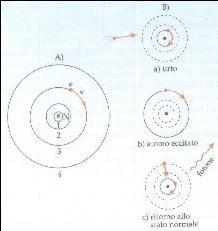 |
Il più basso livello di energia in cui può stare l'elettrone di un atomo si chiama stato fondamentale , e quando assorbe un fotone per muoversi ad un livello maggiore, questo si chiama stato eccitato. |
La legge matematica dei possibili livelli energetici di un atomo di idrogeno è:
dove
k è una costante di proporzionalità
q è la carica elementare e
a o è il raggio dell'atomo di idrogeno allo stato fondamentale
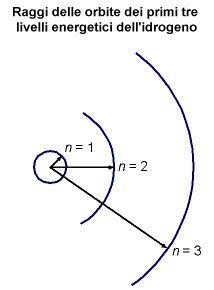
n è il livello energetico, iniziando con 1 per lo stato fondamentale, e aumentando a 2, 3, 4, . . .
Perciò l'energia dello stato fondamentale di un atomo di idrogeno è:
Il segno negativo (-) significa semplicemente che l'elettrone è legato al protone.
Dove eV sta per electron volt ed è uguale a:
Sapendo questo è più semplice definire i livelli energetici come:
e la differenza tra diversi livelli energetici come:
dove n 1 il livello energetico iniziale ed n 2 quello finale .
Livello energetico iniziale:
Livello energetico finale:
L'energia di ogni livello è:
La differenza di energia tra i due livelli è:
o
Questa variazione di energia corrisponde all'emissione di un fotone con una lunghezza d'onda di:
corrispondente alla linea blu dello spettro dell'idrogeno: un elettrone che salta dal quinto livello energetico al secondo.
Tutto quello di cui si è discusso si applica all'atomo di idrogeno, data la sua semplicità. Quando che si passa allo studio di atomi più complessi la struttura e le leggi che li governano diventano più complesse.
Per fortuna molte stelle, incluso il nostro Sole, sono composte pressoché interamente di idrogeno. E, come potete aspettarvi, le linee spettrali discusse qui sono una enorme risorsa per la comprensione delle stelle.
Le stelle sono classificate secondo il loro spettro. Mentre si può determinare approssimativamente la temperatura della superficie di una stella semplicemente guardandola (le più calde a ~35,000 K sono blu, le più fredde a ~3,000 K sono rosse; il Sole, tra quelle più fredde a ~5600 K, è gialla), questa può essere determinata più precisamente con l'analisi spettrografica, e le stelle sono raggruppate, dalla più calda alla più fredda, come O, B, A, F, G, K, M (Oh Be A Fine Girl, Kiss Me). Così il nostro sole è una stella G2, Betelgeuse (la stella rossa di Orione) è una M2 e Sirio (la più luminosa stella del nostro cielo) è una A1.
Lo spettro dell'idrogeno gioca un ruolo fondamentale in questa classificazione. Quando la temperatura della superficie della stella è più alta di 10,000 K, gli elettroni hanno abbastanza energia per lasciare il protone, e non si vedono spettri di idrogeno. Quando le linee dell'idrogeno sono preponderanti (queste linee sono chiamate serie di Balmer dello spettro visibile), sappiamo che la temperatura della stella è circa 10,000 K (Stelle della classe A). E quando la serie di Balmer è presente ma non dominante, sappiamo che la temperatura della stella è sotto i 10,000 K.
Domande da interrogazione
- Qual era la concezione iniziale degli atomi prima della scoperta dell'elettrone?
- Come ha contribuito Ernest Rutherford alla comprensione della struttura atomica?
- Qual è stata l'innovazione di Niels Bohr nella teoria atomica?
- Come si classificano le stelle in base al loro spettro e temperatura?
- Qual è il ruolo dello spettro dell'idrogeno nella classificazione delle stelle?
Inizialmente, i fisici pensavano che gli atomi fossero entità indivisibili, ma la scoperta dell'elettrone dimostrò che questa idea era errata.
Ernest Rutherford scoprì che l'atomo è in gran parte vuoto e propose che gli elettroni orbitano intorno a un nucleo carico positivamente, simile ai pianeti intorno al Sole.
Niels Bohr integrò la teoria atomica con la teoria quantistica della luce, postulando che gli elettroni hanno livelli di energia specifici e emettono fotoni quando passano da un livello energetico più alto a uno più basso.
Le stelle sono classificate in base al loro spettro e temperatura superficiale, con classi che vanno da O (più calde) a M (più fredde), e il Sole è una stella di classe G2.
Lo spettro dell'idrogeno, in particolare la serie di Balmer, è fondamentale per determinare la temperatura delle stelle e la loro classificazione, indicando temperature intorno ai 10,000 K per le stelle di classe A.

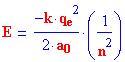
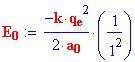
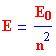
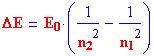
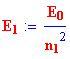
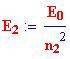
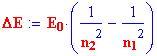





 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo