Concetti Chiave
- L'atomo è la più piccola parte della materia, composto da protoni, neutroni ed elettroni, con protoni e neutroni che determinano principalmente la massa.
- Storicamente, diversi modelli atomici sono stati proposti, tra cui quelli di Thomson, Rutherford, Bohr e il modello quanto-meccanico, che descrivono la struttura e il comportamento degli atomi.
- Il modello quanto-meccanico differisce da quello di Bohr in quanto non definisce orbite precise per gli elettroni, ma utilizza orbitali per descrivere la probabilità della loro posizione attorno al nucleo.
- I numeri quantici descrivono le caratteristiche degli orbitali atomici e includono il numero quantico principale, secondario, magnetico e di spin.
- Il riempimento degli orbitali atomici segue un ordine specifico basato su livelli energetici, riempiendo prima i livelli più bassi e rispettando il principio di esclusione di Pauli.
In questo appunto viene descritto il concetto di atomo, con analisi della sua definizione, delle sue caratteristiche principali, il concetto di numero atomico, il concetto di numero di massa e anche dei numeri quantici.
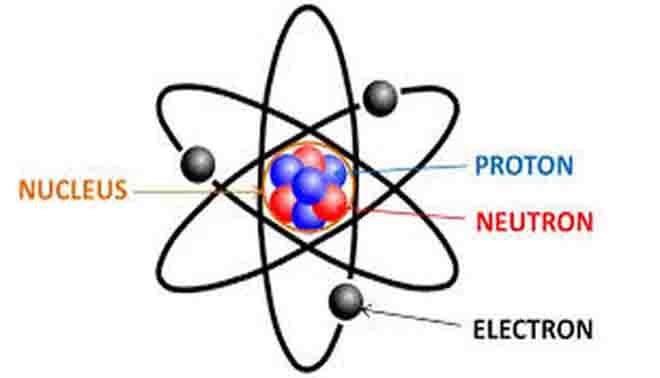
L'atomo
L'atomo è la più piccola parte della materia, è formato dalle seguenti particelle:- l’elettrone, particella carica negativamente;
- il protone, particella carica positivamente;
- il neutrone, particella priva di carica la cui massa è pari a quella del protone.
Il protone e il neutrone hanno una massa relativa pari a 1 mentre l'elettrone ha una massa irrilevante, quindi la massa dell'atomo è data dai neutroni e dagli elettroni. Generalmente in un atomo il numero dei protoni e quello degli elettroni è uguale, per cui l'atomo è neutro. Se l'atomo perde elettroni si carica positivamente e diventa uno ione positivo, se un atomo acquista elettroni si carica negativamente e diventa uno ione negativo.
Gli scienziati nel tempo hanno formulato diversi modelli atomici per spiegare la struttura dell’atomo. Nel 1898 Thomson elaborò un modello secondo il quale l’atomo era simile ad una sfera contenente cariche positive e cariche negative in ugual numero e uniformemente distribuite (Modello atomico di Thomson).
Rutherford nel 1910 stabilì che l’atomo era costituito da una zona centrale, detta nucleo, contenente i protoni, attorno alla quale ruotavano, a varie distanze, su diverse orbite circolari, gli elettroni in numero uguale ai protoni presenti nel nucleo. Questo modello fu anche detto planetario perché simile al sistema solare (Modello atomico di Rutherford).
La teoria di Rutherford però mostrava i seguenti difetti:
- gli elettroni durante il loro moto dovrebbero perdere energia e cadere nel nucleo con conseguente distruzione degli atomi, cosa che in realtà non si verifica.
- questo modello inoltre non spiega l’emissione di energia in forma discontinua da parte degli atomi.
- Questi difetti furono superati dal modello atomico di Bohr che fu elaborato tra il 1913 e il 1915.
Secondo Bohr l’atomo di ogni elemento è costituito da un nucleo centrale, formato da protoni e neutroni, attorno al quale ruotano gli elettroni. Il movimento degli elettroni avviene però su orbite particolari dette orbite stazionarie. Il movimento degli elettroni sulle orbite avviene senza assorbimento né emissione di energia, quindi l’elettrone ruotando entro un’orbita non perde energia e non può cadere nel nucleo. Le orbite stazionarie sono considerate livelli di energia.
Tutte le volte che un elettrone si sposta da un livello di energia maggiore ad uno di energia minore cede energia, viceversa acquista energia quando passa da un livello di energia minore ad uno di energia maggiore. In questi passaggi l’elettrone cede o acquista energia in modo quantizzato, cioè secondo quantità ben definite dette quanti di energia.
Il modello atomico di Bohr però contrastava con il principio di indeterminazione di Heisenberg (1927) secondo il quale è impossibile assegnare all’elettrone, in un dato istante, una ben precisa posizione nell’orbita di appartenenza.
Fu allora formulato il modello quanto-meccanico o a orbitali atomici, secondo il quale gli atomi sono formati da un nucleo centrale contenente i protoni e i neutroni, attorno ad esso girano gli elettroni disposti in differenti livelli di energia. Gli elettroni però non occupano orbite ben precise attorno al nucleo ma si trovano con maggiore frequenza in determinate zone dello spazio attorno al nucleo, tali zone sono dette orbitali atomici.
Gli orbitali atomici sono, quindi, le zone dello spazio attorno al nucleo in cui vi è la maggiore probabilità di trovare un elettrone.

La principale differenza tra questa teoria e quella di Bohr è che secondo Bohr gli elettroni si trovano all’interno di orbite ben definite, mentre secondo il modello quanto-meccanico gli elettroni si trovano negli orbitali che rappresentano la zona attorno al nucleo dove c’è la maggiore probabilità di trovare l’elettrone.
per ulteriori approfondimenti sull'atomo vedi anche qua
Numeri quantici
Le caratteristiche di ciascun orbitale vengono descritte dai numeri quantici che sono:- Numero quantico principale n. Il numero quantico principale n indica lo strato o livello energetico dell’elettrone e può assumere i valori da 1 a 7.
- Numero quantico secondario l. Il numero quantico secondario indica il sottolivello di un determinato livello energetico. Tali sottolivelli si indicano con le lettere s, p, d, f.
- Numero quantico magnetico m. Il numero quantico magnetico m determina il numero di orbitali possibili per ciascun sottolivello.
- Numero quantico di spin ms . il numero di spin indica il senso di rotazione dell’elettrone intorno al proprio asse. Lo spin può essere orario o antiorario.
- Principio di esclusione di Pauli. Il principio di Pauli afferma che un orbitale atomico può contenere soltanto due elettroni che devono avere spin opposto.
per ulteriori sui numeri quantici vedi anche qua
Riempimento degli orbitali atomici
I livelli energetici vengono riempiti dagli elettroni a partire dal livello più basso, e ogni livello viene occupato fino al massimo delle sue capacità, prima che venga impegnato il successivo livello a maggiore energia.L’ordine di riempimento dei diversi orbitali è il seguente:
1s, 2s,2p,3s,3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d…
Le regole che si seguono sono le seguenti:
- il riempimento degli orbitali da parte degli elettroni avviene a partire dal livello energetico più basso, procedendo poi nell’ordine crescente dell’energia;
- un orbitale può contenere al massimo due elettroni, con spin opposto;
- se sono disponibili più orbitali di pari energia, gli elettroni si dispongono uno per ciascuno di essi, con spin paralleli, solo successivamente completano il riempimento.
Altri concetti
Numero atomico: indica il numero di protoni (e quindi anche di elettroni) presenti in un elemento.Numero di massa: indica la somma del numero dei protoni e dei neutroni presenti in un elemento.
Isotopi: sono isotopi gli elementi che hanno lo stesso numero atomico ma diverso numero di massa.
Per esempio se un atomo ha 10 protoni e 12 neutroni, il suo numero atomico sarà 10 perché corrisponde al numero di protoni, il suo numero di massa sarà 22 perché corrisponde alla somma dei protoni e dei neutroni (10+12=22). Questo atomo inoltre ha 10 elettroni perché in un atomo neutro il numero degli elettroni è uguale a quello dei protoni.
Domande da interrogazione
- Quali sono le particelle che compongono un atomo e quali sono le loro caratteristiche principali?
- Come si differenziano i modelli atomici di Thomson, Rutherford e Bohr?
- Cosa sono i numeri quantici e quali informazioni forniscono?
- Qual è l'ordine di riempimento degli orbitali atomici?
- Cosa sono il numero atomico e il numero di massa, e come si differenziano gli isotopi?
Un atomo è composto da elettroni (carica negativa), protoni (carica positiva) e neutroni (senza carica). I protoni e i neutroni hanno una massa relativa pari a 1, mentre la massa degli elettroni è irrilevante.
Il modello di Thomson descrive l'atomo come una sfera con cariche positive e negative distribuite uniformemente. Rutherford introduce il nucleo centrale con protoni e orbite per gli elettroni. Bohr propone orbite stazionarie per gli elettroni, senza perdita di energia.
I numeri quantici descrivono le caratteristiche degli orbitali atomici: il numero quantico principale (n) indica il livello energetico, il numero quantico secondario (l) il sottolivello, il numero quantico magnetico (m) il numero di orbitali, e il numero di spin (ms) il senso di rotazione dell'elettrone.
Gli orbitali atomici vengono riempiti in ordine di energia crescente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, seguendo il principio che un orbitale può contenere al massimo due elettroni con spin opposto.
Il numero atomico indica il numero di protoni in un elemento, mentre il numero di massa è la somma di protoni e neutroni. Gli isotopi hanno lo stesso numero atomico ma un diverso numero di massa.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo