Concetti Chiave
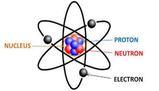
- L'atomo è composto da un nucleo centrale con protoni e neutroni, circondato da elettroni che ruotano su orbite definite.
- La stabilità di un atomo dipende dall'equilibrio tra le forze di attrazione e repulsione, mantenendo la neutralità elettrica.
- L'esperimento di Rutherford ha dimostrato la presenza di componenti positive e negative nell'atomo, utilizzando una lamina di metallo e raggi α.
- Il modello atomico di Bohr descrive gli elettroni che si muovono su orbite prefissate, rilasciando energia sotto forma di luce.
- Sommerfeld e Heisenberg hanno ampliato e sviluppato le teorie quantistiche, evidenziando la complessità della struttura atomica.
L'atomo
La materia è costituita da atomi.
L'atomo è costituito da un nucleo centrale formato da particelle cariche positivamente dette protoni e da particelle neutre dette neutroni.
Intorno al nucleo ruotano su orbite predefinite particelle cariche negativamente chiamate elettroni.
Per far in modo che un atomo possa essere definito stabile è necessario che le forze di attrazione tra cariche opposte e di repulsione tra cariche uguali siano perfettamente bilanciate in modo da annullarsi l'un l'altro.
In questo modo l'atomo mantiene la neutralità elettrica ed il livello energetico più basso.
Tutto ciò è garantito dal fatto che per ogni elemento della tavola periodica c'è un numero atomico identificato con Z :
Numero protoni = numero neutroni = numero elettroni.
Da cui il numero delle cariche positive è uguale a quello delle cariche negative e quelle neutre quindi si ha il bilanciamento e quindi la neutralità elettrica.
Gli elettroni sono 1800 volte più piccoli dei protoni e neutroni.
Le informazioni che abbiamo sull'atomo vengono da una serie di studi ed esperimenti.
Tra i più importanti troviamo l'esperimento Rutherford.
Con questo esperimento si arrivò ad affermare che l'atomo è composto da una componente positiva e una negativa. Per l'esperimento si usò una lamina di metallo sottile e cominciò a bombardarla con raggi α carichi negativamente.
Dopo il bombardamento notò che le particelle si comportavano in modo diverso. Infatti alcune si fermavano sulla lamina mentre altre la oltrepassavano e altre ancora tornavano indietro formando in questo modo diversi angoli di incidenza.
Rutherford affermò quindi che:
• Le prime si fermavano perché andavano a scontrarsi con la componente dell'atomo carica positivamente (cariche opposte si attraggono)
• le seconde passavano attraverso della lamina perché si scontravano con le cariche neutre
• Le terze le particelle che tornavano indietro andavano a scontrarsi con le cariche negative dell'atomo (cariche uguali si respingono)
Nel 1913 lo studioso Bohr, in base all'esperimento di Rutherford propose un modello usando l'atomo di idrogeno, che ha numero atomico Z=1. Secondo questo modello l'unico elettrone che l'idrogeno presenta ruota su orbite prefissate, passando da livelli energetici più bassi a livelli energetici più alti. Nel ripristinare lo stato iniziale (energia più bassa) rilascia energia sotto forma di luce in quantità costante. Questo modello si rivelò innovativo ma non applicabile ad elementi con più di un elettrone, per cui non ebbe grandi consensi.
Un contributo più rilevante però riguardò la fase iniziale di elaborazione della teoria quantistica con Sommerfeld che estese la teoria di Bohr, aggiungendo alcune orbite ellittiche (modello atomico Bohr-Sommerfled) per illustrare quantitativamente la struttura fine delle righe dello spettro dell'idrogeno e applicò la meccanica ondulatoria dello studio del comportamento degli elettroni nei metalli.
Tra i suoi allievi prevale Heisemberg che fornì il contributo alla teoria della struttura atomica.
Heisemberg nel 1925 elaborò una formulazione della meccanica quantistica denominata "meccanica delle matrici" che si fonda sulle frequenze e sulle ampiezze delle radiazioni sorbite ed emesse dall'atomo del corso delle transizioni tra i livelli energetici del sistema atomico. Da qui enunciò il principio di intedeterminazione secondo cui è impossibile determinare con la stessa precisione la posizione e la velocità di una particella.
Domande da interrogazione
- Qual è la composizione di un atomo?
- Cosa garantisce la stabilità di un atomo?
- Qual è stato il contributo dell'esperimento di Rutherford alla comprensione dell'atomo?
- In che modo il modello di Bohr ha contribuito alla teoria atomica?
- Qual è il principio di indeterminazione di Heisenberg?
Un atomo è costituito da un nucleo centrale con protoni e neutroni, e da elettroni che ruotano intorno al nucleo su orbite predefinite.
La stabilità di un atomo è garantita dal bilanciamento delle forze di attrazione e repulsione tra cariche opposte e uguali, mantenendo la neutralità elettrica.
L'esperimento di Rutherford ha dimostrato che l'atomo è composto da una componente positiva e una negativa, evidenziando il comportamento delle particelle in base alle loro cariche.
Il modello di Bohr ha introdotto l'idea di elettroni che ruotano su orbite prefissate e il rilascio di energia sotto forma di luce, sebbene fosse limitato agli atomi con un solo elettrone.
Il principio di indeterminazione di Heisenberg afferma che è impossibile determinare con precisione sia la posizione che la velocità di una particella simultaneamente.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo