Concetti Chiave
- John Dalton studiò che ogni tipo di atomo ha proprietà uniche e una massa caratteristica, fondamentali per interpretare i fenomeni chimici.
- Lavoisier dimostrò la Legge della Conservazione della Materia attraverso esperimenti che non mostrarono variazioni di massa nei reagenti e nei prodotti di reazione.
- La Legge della Composizione Costante di Proust evidenziò che i composti purificati contengono sempre gli stessi elementi nel medesimo rapporto di massa.
- Gli esperimenti con i raggi catodici rivelarono che gli atomi sono composti da particelle più piccole: protoni, neutroni ed elettroni.
- Il numero atomico (Z) indica la quantità di protoni ed elettroni, mentre il numero di massa (A) è la somma di protoni e neutroni in un atomo.
John Dalton arrivò a studiare che ciascun tipo di atomo deve avere proprietà sue, e soprattutto una massa caratteristica.
I composti che possono essere trasformati in due o più nuove sostanze devono contenere due o più diversi tipi di atomi.
Queste sue idee potevano essere usate per interpretare i fenomeni chimici.
Studiò che:
- tutta la materia è costituita da atomi
- tutti gli atomi di un elemento sono uguali sia nella massa che nelle proprietà, - - atomi di elementi diversi hanno masse e proprietà diverse
- gli atomi sono le unità delle trasformazioni chimiche.
Una reazione chimica può dare una combinazione, non separazione; ma gli atomi non si creano, non si distruggono, ne vengono trasformati in altri tipi di atomi.
Legge della Conservazione della Materia: Lavoiser fece un'esperimento, dove erano pesati accuratamente i reagenti prima della reazione chimica e poi dopo i prodotti di reazione; egli non trovò nessuna variazione nelle masse dopo la reazione.
Legge della Composizione Costante: Proust scoprì che un composto, dopo essere stato purificato, conteneva sempre gli stessi elementi nel medesimo rapporto di massa.
Comunque anche dopo le varie scoperte degli scienziati, oggi si sa che gli atomi hanno una loro struttura, e questo è importante perchè permette di capire come e perchè gli atomi si uniscono per formare le molecole.
L'elettrolisi è il passaggio della corrente elettrica attraverso la soluzione di un composto, può causare una reazione chimica, come per esempio la deposizione di oro o argento sulla superficie di un altro metallo o la produzione di cloro a partire da cloruro di sodio.
Furono effettuate molte prove, per affermare che gli atomi sono composti da particelle ancora più piccole; gli esperimenti venivano fati attraverso dei tubi di vetro dove era stata tolta la maggior parte di aria e che avevano un pezzo di metallo, che venne chiamato elettrodo, che era stato sigillato in entrambe le estremità.
Quando agli elettroni gli fu data una differenza di potenziale molto alta, un fascio di particelle (raggio catodico), uscì dall'elettrodo carico negativamente (catodo), e andò verso l'elettrodo positivo (anodo).
I raggi catodici viaggiano in linea retta, formando delle ombre nette, rendono luminosi i gas e le sostanze fluorescenti.
Quando i raggi catodici colpiscono uno schermo fluorescente, si forma una luce sotto forma di piccoli lampi.
Un raggio catodico è un fascio di particelle cariche negativamente, dove ognuna produce un lampo di luce quando colpisce uno schermo fluorescente.
Visto che gli atomi sono privi di carica, in un atomo il numero di protoni deve essere uguale al numero degli elettroni.
I neutroni sono privi di carica elettrica, e hanno una massa simile a quello di un protone.
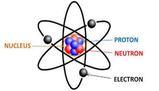
Il nucleo contiene la maggior parte della massa e tutta la carica positiva.
Protoni e neutroni costituiscono il nucleo, gli elettroni carichi negativamente occupano la maggior parte del volume di un atomo, ma contribuiscono molto poco alla sua massa.
Visto che l'atomo è privo di carica elettrica, il numero di elettroni esterni al nucleo deve essere uguale al numero di protoni interni al nucleo.
L'atomo è costituito da:
- protoni: hanno carica positiva, ma non una loro massa;
- elettroni: carica negativa, massa molto piccola;
- neutroni: sono stabili, hanno una massa propria, carica neutra.
I protoni e i neutroni si trovano all'interno del nucleo; gli elettroni ruotano intorno ad esso tracciando delle traiettorie ellittiche.
I protoni hanno lo stesso numero degli elettroni.
Il nucleo è costituito da protoni e neutroni.
Per un atomo che non ha carica elettrica netta, il numero di elettroni carichi negativamente intorno al nucleo è uguale al numero di protoni carichi positivamente nel nucleo.
Numero Atomico (Z): indica quanti elettroni e quanti protoni possiede l'atomo.
Peso Atomico: è la somma degli elettroni e dei protoni.
Numero di Massa (A): è la somma del numero di protoni e neutroni.
Gli elettroni sono cosi leggeri che anche un gran numero di essi non influenza la massa dell'atomo.
Quindi basta solo sommare il numero di protoni e dei neutroni di un atomo per stimare la sua massa.
Domande da interrogazione
- Quali sono le principali scoperte di John Dalton riguardo agli atomi?
- Cosa afferma la Legge della Conservazione della Materia di Lavoisier?
- Qual è il significato della Legge della Composizione Costante di Proust?
- Come si formano i raggi catodici e quale è la loro caratteristica principale?
- Come si calcola il Numero di Massa (A) di un atomo?
John Dalton scoprì che ogni tipo di atomo ha proprietà e una massa caratteristica, che i composti contengono diversi tipi di atomi, e che gli atomi sono le unità delle trasformazioni chimiche.
La Legge della Conservazione della Materia afferma che la massa dei reagenti prima di una reazione chimica è uguale alla massa dei prodotti dopo la reazione, senza variazioni.
La Legge della Composizione Costante stabilisce che un composto purificato contiene sempre gli stessi elementi nello stesso rapporto di massa.
I raggi catodici si formano quando un fascio di particelle cariche negativamente esce dall'elettrodo negativo e viaggia in linea retta verso l'elettrodo positivo, producendo lampi di luce su uno schermo fluorescente.
Il Numero di Massa (A) si calcola sommando il numero di protoni e neutroni presenti nel nucleo di un atomo.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo