Concetti Chiave
- La materia è composta da atomi, che a loro volta sono formati da protoni, neutroni ed elettroni.
- I protoni hanno carica positiva, i neutroni sono neutri e gli elettroni hanno carica negativa, con gli elettroni che orbitano attorno al nucleo.
- Un atomo è neutro quando il numero di protoni è uguale al numero di elettroni, annullando le cariche opposte.
- Il numero atomico (Z) rappresenta il numero di protoni nel nucleo, mentre la massa atomica (A) è la somma di protoni e neutroni.
- Gli isotopi sono varianti di uno stesso elemento con lo stesso numero di protoni ma un diverso numero di neutroni.
L'atomo
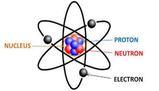
La materia è formata da atomi. In principio si pensava che la materia fosse indivisibile, (atomo dal greco significa infatti indivisibile), ma si è poi scoperto che l'atomo è formato da particelle ancora più piccole.
Le particelle che compongono gli atomi sono: - protoni, che possiedono una carica positiva;
- neutroni, che non hanno carica
- elettroni, che possiedono una carica negativa.
Protoni e neutroni si trovano all'interno del nucleo dell'atomo, mentre gli elettroni si trovano all'esterno del nucleo.
Queste tre particelle hanno massa diversa tra loro. L'elettrone ha una massa minore rispetto agli altri, che invece hanno una massa più grande di circa 2000 volte.
Un atomo è detto stabile quando il numero di protoni (cariche positive) è uguale al numero di elettroni (cariche negative). In questo caso si può anche parlare di atomo neutro, perchè entrambe le cariche essendo uguali in numero vanno ad annullarsi.
Le cariche uguali si respingono. Le cariche opposte si attraggono.
Gli elettroni si muovono in orbite che sono via via più distanti dal nucleo, queste orbite prendono il nome di gusci elettronici. Ogni guscio elettronico può contenere un massimo di otto elettroni.
Il numero di protoni nel nucleo di un atomo è chiamato numero atomico (Z). Es. il numero atomico dell'Ossigeno è 8.
Si definisce massa atomica o numero di massa la somma di protoni e neutroni contenuti in un determinato atomo (A).
La massa dovrebbe essere espressa in chilogrammi secondo il Sistema Internazionale, ma dato che si otterrebbero dei numeri piccolissimi si utilizza come unità di misura 1/12 della massa del carbonio.
Numero di elettroni= A-Z
Numero di elettroni= MASSA ATOMICA - NUMERO ATOMICO
ISOTOPI: atomi di uno stesso elemento che possiedono lo stesso numero di protoni ma un diverso numero di neutroni.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo