Concetti Chiave
- Gli amminoacidi sono le unità strutturali delle proteine, composti da un gruppo carbossilico, uno amminico e una catena laterale variabile.
- Solo 20 amminoacidi partecipano alla sintesi proteica, suddivisi in essenziali (da ottenere con la dieta) e non essenziali (sintetizzati dall'organismo).
- Gli amminoacidi si classificano in apolari (idrofobici), polari (idrofilici), acidi e basici, basandosi sulle proprietà delle loro catene laterali.
- I 9 amminoacidi idrofobici hanno catene apolari, come la glicina e la leucina, mentre i 6 idrofilici contengono catene polari, come la serina e la cisteina.
- Gli amminoacidi acidi, come l'acido aspartico, hanno un secondo gruppo carbossilico, mentre i basici, come la lisina, contengono gruppi amminici.
In questo appunto vengono trattati gli amminoacidi che compongono le proteine, con particolare attenzione alla loro classificazione, descrivendo la loro struttura e riportando le maggiori caratteristiche.
Indice
- Amminoacidi: cosa sono e quali funzioni hanno
- Struttura e classificazione degli amminoacidi
- Amminoacidi idrofobici: quali sono e che struttura hanno
- Amminoacidi idrofilici: quali sono e che struttura hanno
- Amminoacidi acidi: quali sono e che struttura hanno
- Amminoacidi basici: quali sono e che struttura hanno
Amminoacidi: cosa sono e quali funzioni hanno
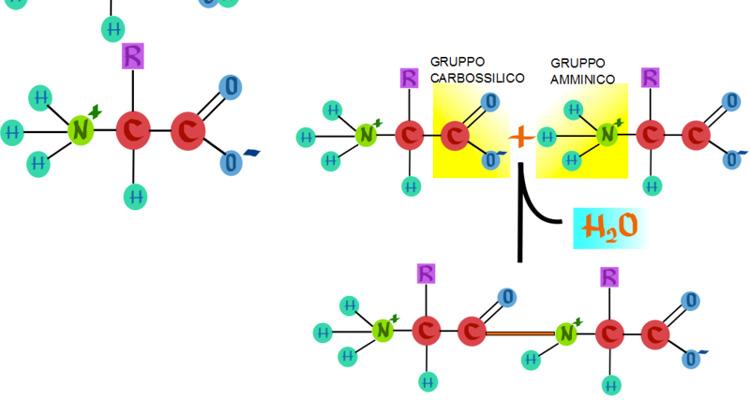
Gli amminoacidi rappresentano l’unità strutturale delle proteine: questi componenti di piccole dimensioni vengono uniti mediante un legame (detto legame peptidico) per formare una lunga catena che dà origine alla proteina. In particolare, solo 20 degli oltre 500 amminoacidi esistenti sono coinvolti nella sintesi proteica.La maggioranza di essi viene sintetizzata autonomamente dall’organismo, assumendo il nome di amminoacidi non essenziali. La restante parte, che l’organismo non riesce a produrre, è necessario ottenerla mediante la dieta. Tali amminoacidi sono detti amminoacidi essenziali.
La funzione principale degli amminoacidi è, dunque, rendere possibile la formazione delle proteine, necessarie per la crescita e lo sviluppo dell’organismo umano. Tali molecole possono anche partecipare alla sintesi di composti che ricoprono altre importanti funzioni biologiche. Oltre a ciò, gli amminoacidi possiedono una modesta funzione energetica.
Per ulteriori approfondimenti sugli amminoacidi vedi qua
Struttura e classificazione degli amminoacidi
Gli amminoacidi sono composti organici che possiedono un carbonio centrale (noto come carbonio α) legato a:- Un gruppo carbossilico (COOH)
- Un gruppo amminico (NH2)
- Una catena laterale (residuo, R)
In base alle proprietà di tale catena, è possibile classificare gli amminoacidi in quattro gruppi:
- Apolari (idrofobici)
- Polari (idrofilici)
- Acidi
- Basici
Amminoacidi idrofobici: quali sono e che struttura hanno
Esistono ben 9 amminoacidi idrofobici, contenenti catene R apolari (per la presenza di gruppi alchilici o aromatici). Di essi fanno parte:- Glicina (Gly)
- Alanina (Ala)
- Valina (Val)
- Leucina (Leu
- Isoleucina (Ile)
- Fenilalanina (Phe)
- Triptofano (Trp)
- Prolina (Pro)
- Metionina (Met)
L’alanina possiede la più corta catena laterale alchilica, composta da un solo carbonio.
La valina ha un un gruppo isopropilico di forma a V, facile da associare al nome di questo amminoacido.
La leucina e l’isoleucina possiedono complesse catene laterali (rispettivamente un gruppo isobutile e uno secbutile) che le rendono fortemente apolari.
La fenilalanina e il triptofano hanno la catena laterale aromatica. In particolare, la fenilalanina ha un anello benzenico legato alla catena laterale di un’alanina mentre il triptofano presenta un indolo legato alla catena laterale di un’alanina. A partire dal triptofano viene sintetizzata la serotonina, un ormone importante per la regolazione del sonno, dell’umore e della sessualità.
La prolina presenta una catena laterale ad anello (di cinque termini), chiuso sul gruppo amminico in alfa.
La metionina possiede un gruppo CH3S- (metiltio) legato ad una catena di due carboni.
Per ulteriori approfondimenti sugli amminoacidi idrofobici vedi qua
Amminoacidi idrofilici: quali sono e che struttura hanno
Esistono 6 amminoacidi idrofilici, contenenti catene R polari (generalmente per la presenza del gruppo ossidrilico). Di essi fanno parte:- Serina (Ser)
- Treonina (Thr)
- Tirosina (Tyr)
- Cisteina (Cys)
- Asparagina (Asn)
- Glutammina (Gln)
La treonina, rispetto alla serina, ha un carbonio in più nella catena laterale (possiede, quindi, due gruppi alchilici consecutivi e un OH finale). Tale molecola ha un deciso aroma di liquirizia.
La tirosina viene sintetizzata dall’organismo stesso a partire dalla fenilalanina e possiede una catena laterale alcolica aromatica. Dalla tirosina viene prodotta la dopamina, un neurotrasmettitore importante per l’uomo.
La cisteina presenta un metile legato ad un gruppo tioalcolico (SH) terminale. Ha un ruolo fondamentale nelle proteine: i gruppi SH di diverse cisteine contenute nella proteina possono legarsi tra loro creando ponti disolfuro e stabilendo la struttura tridimensionale delle proteine.
L’asparagina e la glutammina derivano rispettivamente dall’acido aspartico e dall’acido glutammico e sono delle ammidi (contengono il gruppo CONH2 terminale).
Amminoacidi acidi: quali sono e che struttura hanno
Gli amminoacidi acidi sono solo due ed entrambi sono caratterizzati da un secondo gruppo carbossilico, posto all’interno della catena laterale. Si tratta di acidi forti, che cedono lo ione idrogreno quando si trovano in soluzioni acquose avanti pH 7. A tale pH, sono presenti dunque sotto forma di sale carbossilato (COO-H+). Fanno parte di questo gruppo:- Acido aspartico (Asp)
- Acido glutammico (Glu)
L’acido glutammico ha il carbossile terminale (pKa 4,2) legato ad una catena di due carboni. La forma salificata, nota come glutammato, è un importante neurotrasmettitore eccitatorio del SNC.
Per ulteriori approfondimenti sugli amminoacidi acidi vedi qua
Amminoacidi basici: quali sono e che struttura hanno
Gli amminoacidi basici contengono gruppi amminici basici e sono tre:- Lisina (Lys
- Arginina (Arg)
- Istidina (His)
L’arginina è il più basico degli amminoacidi: ha un gruppo guanidinico terminale (pKa 12,5) legato ad una catenella di tre carboni.
L’istidina ha un anello imidazolico terminale (pKa 6,1) legato ad una catenella di un solo carbonio.
Per ulteriori approfondimenti sugli amminoacidi basici vedi qua
Domande da interrogazione
- Cosa sono gli amminoacidi e quali funzioni svolgono?
- Come sono strutturati e classificati gli amminoacidi?
- Quali sono gli amminoacidi idrofobici e che caratteristiche hanno?
- Quali amminoacidi sono considerati idrofilici e qual è la loro struttura?
- Quali sono le caratteristiche degli amminoacidi acidi e basici?
Gli amminoacidi sono le unità strutturali delle proteine, essenziali per la crescita e lo sviluppo dell'organismo umano. Solo 20 amminoacidi partecipano alla sintesi proteica, di cui alcuni sono essenziali e devono essere assunti con la dieta.
Gli amminoacidi hanno un carbonio centrale legato a un gruppo carbossilico, un gruppo amminico e una catena laterale. Sono classificati in apolari (idrofobici), polari (idrofilici), acidi e basici, in base alle proprietà della catena laterale.
Gli amminoacidi idrofobici includono glicina, alanina, valina, leucina, isoleucina, fenilalanina, triptofano, prolina e metionina. Hanno catene R apolari e sono caratterizzati da gruppi alchilici o aromatici.
Gli amminoacidi idrofilici sono serina, treonina, tirosina, cisteina, asparagina e glutammina. Possiedono catene R polari, spesso contenenti gruppi ossidrilici, e partecipano a importanti funzioni biologiche.
Gli amminoacidi acidi, acido aspartico e acido glutammico, hanno un secondo gruppo carbossilico e sono acidi forti. Gli amminoacidi basici, lisina, arginina e istidina, contengono gruppi amminici basici e sono fondamentali per diverse funzioni cellulari.







 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo