Concetti Chiave
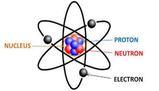
- L'atomo è composto da un nucleo centrale di protoni e neutroni, circondato da elettroni con carica negativa.
- Un atomo è neutro elettricamente perché il numero di protoni positivi è uguale al numero di elettroni negativi.
- Il numero atomico (Z) rappresenta il numero di protoni e determina l'identità dell'elemento.
- Il numero di massa (A) è la somma dei protoni e dei neutroni, indicato in alto a sinistra del simbolo dell'elemento.
- Gli isotopi di un elemento condividono lo stesso numero atomico ma differiscono nel numero di neutroni, mantenendo lo stesso comportamento chimico.
L'atomo - questionario
1. Qual è la composizione dell’atomo?
La parte centrale si chiama nucleo ed è formata da protoni e neutroni.
I protoni hanno carica elettrica positiva. I neutroni hanno carica elettrica = 0.
Il n° dei protoni e dei neutroni è uguale
Il n° dei protoni è anche uguale a quello degli elettroni
Il n° dei protoni indica il numero atomico (Z)
Il n° dei protoni + n° dei neutroni indica il numero di massa (A)
Esternamente al nucleo troviamo gli elettroni che si muovono ed hanno carica elettrica negativa
2. Da cosa deriva il fatto che un atomo può perdere o acquistare elettroni, ma non protoni
Dal fatto che gli elettroni hanno carica elettrica negativa
3. Come si indica il n° di protoni che si trovano nel nucleo di un atomo?
Il n° dei protoni che corrisponde al n° atomico si indica in basso, a sinistra del simbolo
4. Perché si dice che un atomo è neutro da un punto di vista elettrico?
Perché il n° dei protoni (+) è uguale al n° degli elettroni (-)
5. Come viene indicato il numero atomico di un elemento? Si indica con Z
6. Che cosa caratterizza la grandezza dell’atomo? Il n° atomico (Z)
7. Che cosa indica il simbolo 5N?
Che il n° atomico dell’azoto (Z) è 5, cioè che un atomo di azoto ha 5 elettroni e 5 protoni
8. Che cosa indica A?
A indica il n° di massa, cioè la somma dei protoni e dei neutroni che troviamo in un atomo di un elemento
9. Come si indica il numero di massa (A)?
Con un numero posto in altro, a sinistra del simbolo che rappresenta l’elemento. Es. 12C
10. Come si calcola il n° di massa?
Sommando il n° dei protoni con quello dei neutroni A = P + N
11. Come si calcola il n° dei neutroni?
Togliendo dal n° di massa il n° atomico N = A – Z
Es. N° dei neutroni di C: A = 12C – 6C Un atomo di carbonio è costituito da 6 neutroni
12. Che cosa significa 12 6C?
12 è il numero di massa del C e si ottiene sommando i protoni con i neutroni
6 è il numero atomico del C che corrisponde al n° dei protoni (che è uguale sia al n° dei neutroni che a quello degli elettroni).
13. Che cosa sono gli isotopi?
Gli isotopi sono elementi che hanno lo stesso n° atomico (Z) ma un n° di neutroni diverso. Per questo il n° di massa (A) di un isotopo è diverso
14. Gli isotopi di uno stesso elemento hanno un comportamento chimico diverso?
No. Il comportamento è lo stesso perché la loro differenza sta soltanto nel n° di neutroni mentre il n° di P e E è uguale
15. Il numero di un atomo di Cu e di un suo isotopo è lo stesso?
No, perché cambia il n° di neutroni
16. Come si calcola la massa molecolare di un composto?
Per calcolare la Massa Molecolare (MM) di un composto, bisogna trovare la massa atomica di tutti gli elementi del composto, moltiplicare questi numeri per i pedici (nel caso di H2O 2 2 per l'H e 1 per O) e poi sommare tutti i numeri: si ottiene così così la MM
17. Come potresti definire la massa molecolare?
La massa molecolare (MM) di un composto è uguale alla somma delle masse di tutti gli atomi che sono presenti nella formula
Domande da interrogazione
- Qual è la struttura fondamentale di un atomo?
- Perché un atomo è considerato elettricamente neutro?
- Che cosa sono gli isotopi?
- Come si calcola il numero di massa di un atomo?
- Gli isotopi di uno stesso elemento hanno un comportamento chimico diverso?
Un atomo è composto da un nucleo centrale formato da protoni e neutroni, con elettroni che si muovono esternamente al nucleo. I protoni hanno carica positiva, i neutroni sono neutri, e gli elettroni hanno carica negativa.
Un atomo è neutro perché il numero di protoni, che hanno carica positiva, è uguale al numero di elettroni, che hanno carica negativa.
Gli isotopi sono elementi che hanno lo stesso numero atomico (Z) ma un numero diverso di neutroni, il che comporta un diverso numero di massa (A).
Il numero di massa (A) si calcola sommando il numero di protoni e il numero di neutroni: A = P + N.
No, gli isotopi hanno lo stesso comportamento chimico perché la differenza sta solo nel numero di neutroni, mentre il numero di protoni ed elettroni è uguale.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo