Concetti Chiave
- La concezione atomica iniziò con filosofi antichi come Democrito, che ipotizzarono che la materia fosse formata da particelle indivisibili chiamate atomi.
- John Dalton nel 1808 propose un modello atomico scientifico, affermando che gli atomi erano indivisibili e che le reazioni chimiche coinvolgevano atomi interi.
- William Crookes e JJ Thomson scoprirono l'elettrone, la prima particella subatomica, portando alla creazione del "modello a panettone" di Thomson.
- Rutherford dimostrò che l'atomo ha un nucleo centrale con carica positiva, attorno al quale orbitano gli elettroni, portando al modello atomico "a orbite".
- Il modello atomico di Bohr introdusse l'idea di orbitali e livelli energetici, successivamente perfezionato da Schroedinger con la teoria delle probabilità di posizione degli elettroni.
Atomo
La storia dell’atomo era studiata fin dall’antichità, con i primi filosofi. Un esempio di questi sono Leukippos e Democrito circa nel 450/420 a.C. che ipotizzarono che qualsiasi materia fosse formata da minuscole, invisibili e indivisibili particelle le quali seguono un moto ben preciso.Anche Democrito tuttavia sosteneva qualche affermazione che ai tempi d’oggi si può affermare fosse falsa, infatti lui sosteneva che tutta la realtà fosse divisa in atomi e vuoto.
Epicureo che riprenderà questa concezione e aggiungerà che gli atomi vengono deflessi in modo casuale e possono causare i vari elementi della tavola periodica o di Mendeleev.
In seguito Giordano Bruno nel 1591, Galileo Galilei nel 1612 e Klaproth recuperarono questo concetto ed eseguirono degli ulteriori studi e grazie a vari esperimenti riuscirono a rinconfermarle.
Dovettero aspettare circa 400 anni prima che il chimico John Dalton nel 1808 parlò scientificamente dell’atomo che riaffermò che fosse una particella elementare indivisibile, e che gli atomi di uno stesso elemento hanno tutti la stessa massa. Fu il primo a dichiarare che le reazioni chimiche avvengono tra atomi interi e non tra frazioni di atomi e gli atomi di un elemento in un composto conservano le loro caratteristiche chimiche e fisiche e sono indistruttibili.
Ma questo suo comunicato venne dichiarato falso.
Nella metà dell’800 altri studi indotti da Goldstein and Crookes portarono alla nuova scoperta della prima particella subatomica, definita da JJ Thomson “elettrone”.
Crookes realizzò un particolare esperimento:
prima di tutto architettò dei particolari tubi in vetro dalla forma allungata, e ai due vertici, li collegò ad un generatore di corrente. Diede il nome al polo negativo Catodo mentre il polo positivo lo chiamò Anodo.
All’interno del tubo si trovava un gas rarefatto (10^-5 atmosfere)(il gas è rarefatto perché così non influenza più di tanto l’esperimento) e fece passare la corrente.
Il tubo si illuminò all’istante e Crookes iniziò a vuotare il tubo con una pompa apposita.
All’inizio la luminosità si diffuse parallelamente alla rarefazione di gas, e in seguito si radunò nel Catodo.
A quel punto tentò di collocare davanti a quel fascio di luce un piccolo oggetto e vide che lo stesso fascio ne proiettò l’ombra dell’oggetto, nel mentre riusciva a far ruotare una piccola girandola.
Oltre a ciò egli provò ad adattare una calamita al tubo e notò che la calamita era attratta dal polo positivo(+) e respinto dal polo negativo(-).
Evidentemente quelle strane e misteriose particelle, per quel tempo, dalla natura sia corpuscolare che di onda elettromagnetica dovevano avere carica negativa perché carica negativa(-) come la calamita viene attratta da carica positiva(+) come il polo; mentre cariche dello stesso tipo si respingono.
Grazie a questo giunse inoltre alla conclusione che il gas rarefatto non influisce le particelle e quindi i esse avrebbero dovuto avere la stessa massa e carica in tutti gli elementi.
William Crookes chiamo questi raggi “catodici".
Thomson nel 1897 denominando “elettrone” la particella scoperta da Crookes e Goldstein, realizzò il primo modello atomico. Esso è chiamato “modello di Thomson” o “modello a Panettone” il cui era formato da una sfera circolare di carica neutra (ora detti neutroni) con raggio circa 10^ -10 metri, e con eguale concentrazione di particelle con cariche positive e negative (elettroni e rotoni).
All’inizio del 1900,quando il modello atomico era ancora quello thomsoniano, un chimico neozelandese di nome Rutherford, diffidente del modello dell’altro chimico, decise di creare un esperimento per dimostrare come era composto veramente l’atomo.
Il suo esperimento consisteva nel far propagare le particelle dei raggi α (alfa),(che ricordiamo sono costituite da 1 nucleo di elio), la cui sorgente era un piccolo recipiente in piombo, attraverso un tubicino per bombardare una sottilissima foglia d’oro (spessore 0,01mm) con le suddette onde, la lamina era circondata da una schermo fluorescente di ZnS (solfuro di zinco) e si aspetterebbe , visto il modello a panettone corrente, che tutte le particelle alfa trapassassero la lamina oppure venissero deflesse leggermente. Ovviamente questo perché egli presuppone che un atomo sia “pieno uniformemente” e che quindi per forza la particella alfa dovrebbe o non incontrare ostacoli oppure urtare o una particella + o una -. Scoprì che non sarà così, dal momento che circa 1 ogni 20.000 particelle alfa gli ritorneranno indietro con un angolo di 180°.
Come mai?
A produrre le deflessioni inaspettate non potevano essere gli elettroni in quanto la loro massa era 7.000 volte più piccola.
Infatti era allora la nuvola positiva depositaria della “massa”
dell’atomo. . Ma i conti non tornano. Brevemente infatti, saltando vari calcoli, Rutherford arriva alla conclusione che il campo elettrico medio che deve agire sulle alfa è 10^17 V/m.
Ma con il modello di Thomson il campo massimo di una “nube di carica positiva di quel tipo” può essere solo 10^13V/m, ovvero quattro ordini di grandezza inferiore a quello supposto per produrre questa diffusione.
Per Rutherford allora, le Alfa, poiché di massa molto maggiore, dovevano avere dimensioni confrontabili a quelle degli elettroni e perciò erano molto più piccole rispetto all’ atomo. Rutherford sapeva che le Alfa erano atomi di elio ionizzati due volte (privi di elettroni) e quindi doveva per forza ammettere che questa particella fosse puntiforme e non un pezzo di panettone come affermava JJ Thomson…
Giunse allora alle conclusioni che porteranno alla nuova formazione di modello atomico, che verrà poi chiamato
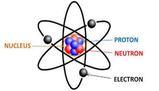
“a orbite” in quanto includeva un “Nucleo”, che per Rutherford era la massa dell’atomo ed era di carica elettricamente positiva, e degli elettroni che orbitano in gusci ben precisi attorno al nucleo detti “orbitali”.
Il nucleo avrebbe, tramite alcuni esperimenti, raggio di 10^-14 m.
Nel 1932 Chadwick arriverà alla scoperta del neutrone nel modo in cui tutti noi sappiamo. Il problema di questo modello atomico, però, è che siccome gli elettroni si muovono, essi devono spendere energia, e quindi in un breve intervallo di tempo, dovrebbero collassare nel nucleo.
Nel 1932 Bohr risolve il problema ipotizzando l’ultimo modello atomico scoperto finora, ovvero il
modello a strati. Ogni elettrone quindi, percorre un’orbita attorno al nucleo prestabilita (orbitali), e dotata di
un suo “livello energetico” fornito dall’energia nucleare dello stesso atomo. Infatti quando si eccita
un elettrone in un atomo, esso tenderà a passare in uno strato di livello energetico superiore e alla
fine dell’eccitazione torna allo stato stazionario precedente.
Nel 1940 E. Schroedinger scoprì che si può trovare l’elettrone in base a una fascia di probabilità di presenza in quanto non possiamo misurare nel mentre la posizione dell’elettrone e la sua velocità e direzione. Le teorie attuali ipotizzano che sia il neutrone che il protone siano composti da quark, particelle elettricamente cariche con cariche pari ad un terzo di quelle dell’elettrone, mentre l’elettrone sia indivisibile quindi non composto da altre particelle di massa inferiore a esso.
Domande da interrogazione
- Qual è l'origine del concetto di atomo?
- Come ha contribuito John Dalton alla teoria atomica?
- Qual è stata la scoperta di William Crookes e come ha influenzato la teoria atomica?
- In che modo l'esperimento di Rutherford ha cambiato la comprensione dell'atomo?
- Quali sono le principali caratteristiche del modello atomico di Bohr?
Il concetto di atomo risale all'antichità, con filosofi come Leukippos e Democrito che ipotizzarono che la materia fosse composta da particelle minuscole, invisibili e indivisibili.
John Dalton, nel 1808, ha riaffermato scientificamente che l'atomo è una particella elementare indivisibile e che gli atomi di uno stesso elemento hanno la stessa massa, introducendo l'idea che le reazioni chimiche avvengono tra atomi interi.
William Crookes ha scoperto i raggi catodici, dimostrando l'esistenza di particelle cariche negativamente, che JJ Thomson ha poi chiamato "elettroni", portando alla formulazione del modello atomico di Thomson.
L'esperimento di Rutherford ha dimostrato che l'atomo non è "pieno uniformemente" come suggerito dal modello di Thomson, ma ha un nucleo centrale con carica positiva, portando alla formulazione del modello atomico a orbite.
Il modello atomico di Bohr ipotizza che gli elettroni orbitano attorno al nucleo in orbitali prestabiliti, ciascuno con un proprio livello energetico, risolvendo il problema del collasso degli elettroni nel nucleo.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo