Concetti Chiave
- Gli atomi sono le unità fondamentali della materia e si combinano in molecole, formando milioni di coppie diverse.
- Lavoisier e Proust introdussero il principio di conservazione della massa e la legge delle proporzioni definite, fondamentali nella chimica.
- Rutherford sviluppò il modello nucleare dell'atomo, descrivendo un nucleo denso e carico positivamente circondato da elettroni in movimento.
- Gli elettroni orbitano in livelli energetici concentrici attorno al nucleo, con il numero di elettroni negli strati esterni che determina le proprietà chimiche.
- Gli isotopi sono varianti di un elemento con lo stesso numero atomico ma diverso numero di neutroni, formando una famiglia isotopica.
È l’ unità fondamentale della materia. Esistono 90 tipi di atomi, chiamati elementi. Legandosi gli atomi formano delle molecole che possono abbinarsi in milioni di coppie. Ogni elemento è rappresentato da un simbolo. Le sostanze sono identificate da formule chimiche.
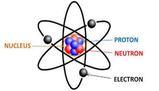
Struttura atomica
1° dato sperimentale: il chimico Antoine Lavoisier scoprì che, in una reazione chimica in un sistema chiuso, la massa totale dei reagenti che si trasformano è uguale alla massa totale dei prodotti di reazione: principio di conservazione della massa.
2° dato sperimentale: Joseph Proust aveva osservato che sostanze specifiche contengono sempre elementi nello stesso rapporto di massa. Questo principio è noto come legge delle proporzioni definite. John Dalton affermò che tutta la materia è costituita da particelle molto piccole che non potevano essere ulteriormente suddivise. Chiamò queste particelle atomi. Formulò una seconda teoria: il rapporto delle masse di un elemento che si combina con una massa costante di un altro elemento si può esprimere mediante numeri interi e piccoli: legge delle proporzioni multiple. L’atomo di Dalton può essere rappresentato come una sfera piena.
Joseph Thomson ipotizza un modello di atomo costituito da particelle dotate di carica elettrica positiva (protoni) tra le quali sono presenti particelle di carica negativa (elettroni): modello a panettone.
Ernest Rutherford riunì un brillante gruppo di fisici. I risultati osservati furono:
- la maggior parte delle particelle αlphα attraversava la lamina d’ oro come se essa non costituisse alcun ostacolo;
- alcune particelle subivano una deviazione più o meno grande rispetto alla linea immaginaria perpendicolare alla lamina;
- in pochissimi casi accadeva che la particella non attraversasse la lamina e rimbalzasse all’ indietro.
Rutherford cercò di immaginare ciò che incontravano le particelle αlphα nell’attraversare la lamina. Questo ostacolo doveva essere un nucleo piccolo e pesante dotato di carica positiva così le particelle venivano deviate poiché entrambe avevano carica positiva. Il modello nucleare che fu elaborato sulla base di questo esperimento prevede che:
- l’ atomo può essere paragonato ad una sfera al cui centro è posto il nucleo;
- il nucleo è formato da protoni e neutroni;
- gli elettroni si muovono intorno al nucleo occupando un volume molto grande rispetto a quello del nucleo;
- il nucleo ha carica elettrica positiva;
- la massa dell’ atomo è quasi tutta concentrata nel nucleo;
- il volume dell’ atomo è stabilito dalla nuvola di carica negativa. L’ atomo ha un diametro che vale circa 105 volte quello del suo nucleo;
- la maggior parte del volume dell’ atomo è costituito dallo spazio vuoto occupato dagli elettroni in continuo movimento.
Il numero dei protoni presenti nel nucleo si chiama numero atomico (Z).
Il numero totale di neutroni e protoni presenti nel nucleo di ogni atomo si chiama numero di massa (A).
Numero di neutroni = numero di massa (A) – numero atomico (Z)
Vengono chiamati isotopi gli atomi di un elemento (= numero atomico) che contengono un diverso numero di neutroni (diverso numero di massa). Con il termine famiglia isotopica si indica l’ insieme degli isotopi di uno stesso elemento.
Elettroni e livelli energetici
Gli elettroni ruotano attorno al nucleo seguendo orbite precise. Gli elettroni sono disposti in strati o gusci concentrici intorno al nucleo. Ogni strato elettronico possiede un preciso livello energetico. Gli elettroni si dispongono nei diversi livelli energetici secondo regole precise.
- Primo livello: è il più piccolo e può contenere al massimo due elettroni;
- secondo livello: può contenere al massimo otto elettroni;
- dal terzo al settimo livello: ogni atomo ha nel suo nucleo da uno a otto elettroni.
Il numero degli elettroni presenti nello strato più esterno determina le proprietà chimiche di ogni elemento, ossia la tendenza degli atomi di ogni elemento a reagire e combinarsi con altri atomi. Gli elettroni nello strato esterno sono detti elettroni di valenza.
Ogni livello è suddiviso in sottolivelli:
- Primo livello: comprende un sottolivello chiamato S che può contenere fino a due elettroni,
- Secondo livello: comprende 2 sottolivelli chiamati S e P con sei elettroni,
- terzo livello: comprende 3 sottolivelli chiamati S, P e D che possono contenere fino a dieci elettroni.
Simboli di Lewis: puntini disposti intorno al simbolo dell’ atomo con cui si possono evidenziare gli elettroni di valenza.
Domande da interrogazione
- Qual è l'unità fondamentale della materia e quanti tipi ne esistono?
- Qual è il principio di conservazione della massa scoperto da Antoine Lavoisier?
- Come descrive John Dalton la struttura dell'atomo?
- Qual è il modello atomico proposto da Ernest Rutherford?
- Come sono disposti gli elettroni intorno al nucleo e cosa determina il numero degli elettroni nello strato più esterno?
L'unità fondamentale della materia è l'atomo, e ne esistono 90 tipi, chiamati elementi.
Antoine Lavoisier scoprì che in una reazione chimica in un sistema chiuso, la massa totale dei reagenti è uguale alla massa totale dei prodotti di reazione.
John Dalton descrive l'atomo come una particella molto piccola che non può essere ulteriormente suddivisa, rappresentata come una sfera piena.
Ernest Rutherford propose un modello nucleare in cui l'atomo è paragonato a una sfera con un nucleo centrale composto da protoni e neutroni, e gli elettroni che si muovono intorno al nucleo.
Gli elettroni sono disposti in strati o gusci concentrici intorno al nucleo, e il numero degli elettroni nello strato più esterno determina le proprietà chimiche di ogni elemento.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo