Concetti Chiave
- Il gas perfetto subisce una trasformazione isocora da una pressione di 2,0 kPa a 0,70 kPa mantenendo il volume costante a 1,3 m³.
- Successivamente, avviene una trasformazione isobara a pressione costante di 0,70 kPa, raggiungendo una temperatura di 600 K.
- Le temperature nei tre stati sono calcolate usando l'equazione di stato dei gas: TA = 630 K, TB = 220 K, e TC = 600 K.
- Il volume nello stato C è determinato applicando la legge di Gay-Lussac, risultando in 3,5 m³.
- Il lavoro totale compiuto dal gas è calcolato solo per la trasformazione isobara, risultando in 1,54 kJ.
- Determina per ciascuno degli stati A,B,C i valori delle tre variabili termodinamiche;
- Disegna in un riferimento p-V i grafici che rappresentano le due trasformazioni;
- Calcola il lavoro totale compiuto dal gas durante le due trasformazioni.
Risoluzione quesito 1
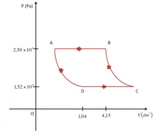
Rappresentiamo in un grafico generale le trasformazioni del gas:

Trasformiamo ora i valori della pressione in Pascal:
Sappiamo che da A a B il gas compie una trasformazione a volume costante, cioè
mentre da B a C il gas compie una trasformazione a pressione costante, cioè
Determiniamo la temperatura nei tre stati della trasformazione utilizzando l'equazione di stato dei gas perfetti:
Ricordiamo che R è la costante universale dei gas e vale
Allo stesso modo, per lo stato B si ha:
Avendo già il valore della temperatura nel punto C applichiamo la prima legge di Gay-Lussac per trovare il volume in quello stato:
Risoluzione quesito 2
Rappresentiamo ora in due riferimenti p-V i grafici delle trasformazioni:

Risoluzione quesito 3
Calcoliamo ora il lavoro compiuto dal gas durante le due trasformazioni; sappiamo che in una trasformazione isocora, poiché non vi è variazione di volume il lavoro è nullo, quindi:
Basterà quindi calcolare il lavoro nel tratto BC. Nel caso di trasformazioni isobare il lavoro è dato dalla formula:
Il lavoro nel tratto BC, quindi, corrisponde alche al lavoro totale :
Domande da interrogazione
- Quali sono i valori delle variabili termodinamiche negli stati A, B e C?
- Come si rappresentano graficamente le trasformazioni isocora e isobara nel piano p-V?
- Qual è il lavoro totale compiuto dal gas durante le due trasformazioni?
- Come si calcola il lavoro durante una trasformazione isobara?
Nello stato A, la pressione è 2,0 kPa, il volume è 1,3 m³ e la temperatura è 630 K. Nello stato B, la pressione è 0,70 kPa, il volume è 1,3 m³ e la temperatura è 220 K. Nello stato C, la pressione è 0,70 kPa, il volume è 3,5 m³ e la temperatura è 600 K.
La trasformazione isocora da A a B è rappresentata da una linea verticale, poiché il volume rimane costante. La trasformazione isobara da B a C è rappresentata da una linea orizzontale, poiché la pressione rimane costante.
Il lavoro totale compiuto dal gas è 1,5 kJ. Durante la trasformazione isocora da A a B, il lavoro è nullo. Durante la trasformazione isobara da B a C, il lavoro è 1,54 kJ.
Il lavoro durante una trasformazione isobara si calcola con la formula \( L = p \cdot \Delta V \), dove \( p \) è la pressione costante e \( \Delta V \) è la variazione di volume. Nel caso specifico, il lavoro è 1,54 kJ.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo