Concetti Chiave
- La teoria atomica di Dalton ha introdotto un modello scientifico per spiegare la struttura della materia, differenziandosi dalle idee filosofiche di Democrito.
- I postulati di Dalton affermano che la materia è composta da atomi indivisibili, con atomi dello stesso elemento che condividono le stesse proprietà chimiche.
- Dalton ha stabilito che durante le reazioni chimiche, gli atomi non scompaiono o si trasformano, ma si combinano per formare nuovi composti con proporzioni costanti.
- Dalton ha influenzato la teoria di Lavoisier, che ha formulato la legge di conservazione della massa, affermando che la massa dei reagenti è pari a quella dei prodotti.
- Proust ha formulato la legge delle proporzioni definite, indicando che le masse degli elementi in un composto si combinano in rapporti costanti e definiti.
Indice
Teoria di Dalton
È importantissimo trattare nella chimica di base della teoria atomica di Dalton, che è un chimico inglese che nacque nel 1808, che propose un modello che fu molto utile, perché riuscì a soddisfare la teoria atomica. Infatti, fece una teoria atomica che si differenziava dalla teoria atomica di Democrito, poiché la differenza tra i due era che Democrito era un filosofo, mentre Dalton era uno scienziato, ed è proprio lì che è stata tutta la differenza tra l'antichità e i giorni d'oggi nostri. Dalton, infatti, per formulare la sua teoria, enunciò dei formulati che sono all'incirca cinque.
Postulati
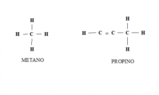
Un primo postulato dice che la materia è formata da atomi che sono materia piccolissima e indivisibile, mentre il secondo dice che gli atomi di uno stesso elemento hanno tutti quanti le stesse proprietà chimiche, e invece, ovviamente, al contrario, atomi di elementi diversi avranno delle proprietà chimiche che sono diverse. Un terzo postulato è che nelle reazioni chimiche che conosciamo nessun atomo degli elementi scompare, o si trasforma in un altro atomo di un altro elemento, ma resta sempre uguale, magari però si va a combinare con altri elementi per formare nuovi composti, e il quarto postulato dice che i composti sono formati dalla combinazione di due o più atomi chimici diversi, e in un particolare composto il numero di atomi di ogni elemento è costante, quindi non è possibile avere una molecola d'acqua che avrà tre atomi di idrogeno, ma, come sappiamo, ne avrà per forza due, e sono sempre numeri interi, come abbiamo visto. Il quinto postulato dice che una molecola è costituita da due o più atomi che sono combinati tra loro, e quindi può essere pensata come un'unica e singola unità. Dalla teoria atomica di Dalton è emersa la teoria anche di Lavoisier, che formulò la legge di conservazione della massa, che in parole molto semplici ci dice che la massa dei reagenti è uguale alla massa dei prodotti, cioè se non abbiamo una reazione chimica, ci abbiamo delle sostanze che reagiscono, che possono ad esempio essere 10 grammi, avremo dei prodotti che equivalgono quindi al peso di 10 grammi, e per questo possiamo dire anche che nulla si crea e nulla si distrugge.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo