Concetti Chiave
- L'atomo di Thomson ha portato alla scoperta degli elettroni, particelle cariche negativamente presenti in tutti gli atomi, definendo il rapporto tra carica e massa degli elettroni.
- Rutherford ha proposto un modello atomico con un nucleo centrale carico positivamente, scoprendo che la maggior parte della massa dell'atomo risiede nel nucleo, mentre gli elettroni ruotano attorno.
- I raggi alfa, beta e gamma hanno caratteristiche distintive: i raggi alfa sono particelle cariche positivamente, i raggi beta sono elettroni veloci, e i raggi gamma sono radiazioni elettromagnetiche di alta energia.
- Bohr ha introdotto un modello atomico basato sulla quantizzazione dell'energia, con elettroni che occupano orbite definite, associate a specifiche quantità di energia.
- Il numero quantico principale, indicato con "n", rappresenta il livello energetico dell'atomo e determina l'energia associata alle orbite degli elettroni.
L'atomo di Thomson
gli elettroni, negativi;i protoni, positivi;J.J Thomson
Fisico inglese (1856-1940) al quale si deve la scoperta degli elettroni cui giunse studiando la conduttività dei gas rarefatti. Determinò la presenza degli elettroni nella struttura dell'atomo misurando il rapporto fra la carica e la massa delle particelle dei raggi catodici.
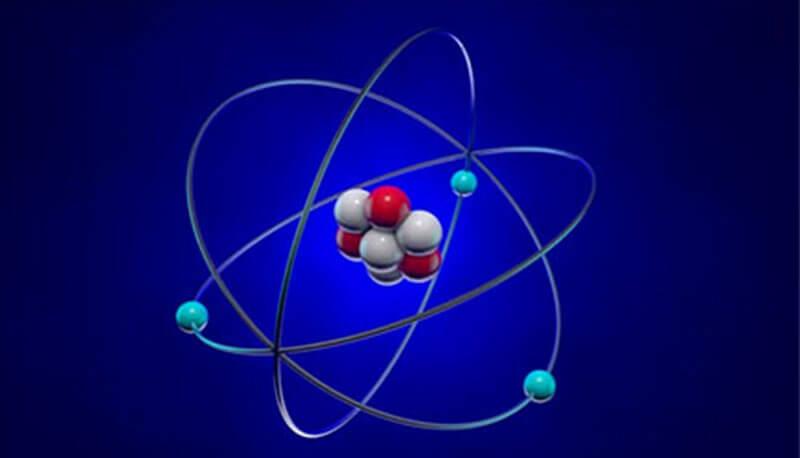 Questa ipotesi fu dimostrata errata da una serie di esperienze conseguenti alla scoperta delle radiazioni spontanee emesse da alcuni elementi, quali ad esempio l'uranio. In particolare lo studio della radioattività mise in evidenza la presenza di tre tipi di radiazioni: raggi alfa, raggi beta e raggi gamma. In un primo momento il fatto che le radiazioni come i raggi alfa fossero in grado di attraversare lamine metalliche, fece ipotizzare un tipo di atomo come quello descritto da Thomson, ma in realtà, grazie agli studi del fisico neozelandese Ernest Rutherford, si dimostrò non essere così. Quest'ultimo attraverso un'apparecchiatura, usò le particelle alfa emesse da una fonte per bombardare una sottile lamina d'oro, posta davanti ad uno schermo circolare fluorescente. Osservando i punti di contatto delle particelle dopo l'attraversamento della lamina d'oro interposta, notò che la maggior parte di esse le attraversava indisturbata, mentre una piccola parte deviava leggermente e solo qualcuna veniva respinta. Ciò significava evidentemente che la materia fosse per la maggior parte "soffice", con all'interno dei punti solidi, duri; le particelle alfa, quindi, venivano deviate o respinte solo quando incontravano le zone dure. Poiché le particelle alfa sono cariche positivamente, Rutherford dedusse che queste zone più dure fossero anch'esse cariche positivamente, provocando la repulsione delle stesse particelle. Sulla base di questi esperimenti, Rutherford propose il suo modello di atomo, in cui la maggior parte della massa è racchiusa nel nucleo (il nocciolo duro degli esperimenti), dotato di carica positiva, con gli elettroni che gli ruotano intorno per attrazione coulombiana, occupando il restante volume atomico. Questo spiega perché i raggi alfa deviano quando sul loro cammino incontravano il nucleo dotato di massa analoga e carica elettrica positiva. Le dimensioni del nucleo sono circa 10.000 volte inferiori a quelle dell'atomo.
Questa ipotesi fu dimostrata errata da una serie di esperienze conseguenti alla scoperta delle radiazioni spontanee emesse da alcuni elementi, quali ad esempio l'uranio. In particolare lo studio della radioattività mise in evidenza la presenza di tre tipi di radiazioni: raggi alfa, raggi beta e raggi gamma. In un primo momento il fatto che le radiazioni come i raggi alfa fossero in grado di attraversare lamine metalliche, fece ipotizzare un tipo di atomo come quello descritto da Thomson, ma in realtà, grazie agli studi del fisico neozelandese Ernest Rutherford, si dimostrò non essere così. Quest'ultimo attraverso un'apparecchiatura, usò le particelle alfa emesse da una fonte per bombardare una sottile lamina d'oro, posta davanti ad uno schermo circolare fluorescente. Osservando i punti di contatto delle particelle dopo l'attraversamento della lamina d'oro interposta, notò che la maggior parte di esse le attraversava indisturbata, mentre una piccola parte deviava leggermente e solo qualcuna veniva respinta. Ciò significava evidentemente che la materia fosse per la maggior parte "soffice", con all'interno dei punti solidi, duri; le particelle alfa, quindi, venivano deviate o respinte solo quando incontravano le zone dure. Poiché le particelle alfa sono cariche positivamente, Rutherford dedusse che queste zone più dure fossero anch'esse cariche positivamente, provocando la repulsione delle stesse particelle. Sulla base di questi esperimenti, Rutherford propose il suo modello di atomo, in cui la maggior parte della massa è racchiusa nel nucleo (il nocciolo duro degli esperimenti), dotato di carica positiva, con gli elettroni che gli ruotano intorno per attrazione coulombiana, occupando il restante volume atomico. Questo spiega perché i raggi alfa deviano quando sul loro cammino incontravano il nucleo dotato di massa analoga e carica elettrica positiva. Le dimensioni del nucleo sono circa 10.000 volte inferiori a quelle dell'atomo.
Lo studio delle radiazioni emesse dagli atomi ha permesso di elaborare nuovi modelli atomici, soppiantando quello proposto de Rutherford, seconda la cui teoria l'atomo è assimilabile ad un sistema planetario, con gli elettroni che ruotano intorno al nucleo centrale, contenete i protoni. Questo modello, in realtà, si è dimostrato imperfetto, poiché un elettrone in movimento intorno al nucleo avrebbe dovuto irradiare energia (con la conseguente diminuzione di questa nel tempo), con successiva diminuzione del raggio dell'orbita fino a precipitare nel nucleo. Ad introdurre un modello più avanzato di atomo fu lo scienziato danese Niels Bohr (1885-1962), il quale, pur mantenendo la concezione planetaria, basò il suo modello sulla quantizzazione dell'energia (Teoria dei quanti). Egli infatti sfruttando questa teoria spiegò gli spettri a righe di emissione degli atomi, ipotizzando che gli elettroni nell'atomo occupano determinate posizioni, alle quali sono associate quantità precise di energia. In sostanza il modello di atomo secondo BOHR ammette che un elettrone ruota attorno al nucleo descrivendo un'orbita ben definita, alla quale compete una quantità di energia ben precisa: all'orbita più vicina al nucleo viene assegnato il livello minimo di energia e quando un elettrone occupa tale livello, si dice che si trova nel suo stato fondamentale. La distanza dal nucleo, ossia il raggio dell'orbita percorsa dall'elettrone, è definita da un numero n, detto numero quantico principale, che può assumere un qualsiasi valore intero. Finché un elettrone percorre una determinata orbita non assorbe né cede energia (orbita stazionaria) e l'energia associata ad essa risulta "quantizzata", essendo di un determinato valore "n". Ma un elettrone può passare da uno stato stazionario ad un altro superiore assorbendo una quantità di energia pari al dislivello energetico esistente fra i due stati: in tal caso si dice che l'atomo è in uno stato eccitato. Viceversa un elettrone può saltare ad un'orbita più interna, nel qual caso è esso a cedere energia sotto forma di fotoni. Un elettrone per passare dalla prima orbita alla terza deve assorbire una quantità di energia pari a E = n3 - n1 (essendo n3 maggiore di n1). Invece per passare dalla terza orbita alla seconda deve cedere una quantità di energia pari a E = n3 - n2 e per ritornare alla prima orbita deve cedere una quantità di energia pari a E = n3 - n1. Il fatto che il passaggio fra vari livelli avvengano con scambi di quantità ben precise di energia, è un'ulteriore conferma che l'energia che gli elettroni sono in grado di emettere o di assorbire è quantizzata.
Domande da interrogazione
- Qual è stata la scoperta principale di J.J. Thomson riguardo all'atomo?
- Come ha contribuito Ernest Rutherford alla comprensione della struttura atomica?
- Quali sono le caratteristiche dei raggi alfa, beta e gamma?
- In che modo Niels Bohr ha migliorato il modello atomico di Rutherford?
- Cosa rappresenta il numero quantico principale nel modello atomico di Bohr?
J.J. Thomson ha scoperto gli elettroni, particelle cariche negativamente presenti in tutti gli atomi, determinando il rapporto tra la loro carica e massa.
Ernest Rutherford ha proposto un modello atomico in cui la maggior parte della massa è concentrata in un nucleo centrale carico positivamente, con gli elettroni che orbitano intorno ad esso.
I raggi alfa sono particelle cariche positivamente con massa simile a un atomo di elio, i raggi beta sono elettroni veloci, e i raggi gamma sono radiazioni elettromagnetiche di alta energia.
Niels Bohr ha introdotto la quantizzazione dell'energia, spiegando che gli elettroni occupano orbite stazionarie con livelli energetici definiti, e possono assorbire o cedere energia per passare tra queste orbite.
Il numero quantico principale indica il livello energetico di un elettrone nell'atomo, con valori interi positivi, determinando la distanza dell'elettrone dal nucleo.







 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo