Concetti Chiave
- I legami chimici si dividono in primari (forti) come covalenti, ionici e metallici e secondari (deboli) come dipolo-dipolo e a idrogeno.
- La regola dell'ottetto stabilisce che un atomo è stabile con otto elettroni nel guscio elettronico, portando alla formazione di legami ionici e covalenti.
- Il legame covalente può essere puro, polare o dativo, con elettroni condivisi tra atomi e rappresentato mediante la notazione di Lewis.
- Il legame ionico si forma tra atomi con una differenza di elettronegatività superiore a 1,9, come nel caso del cloruro di sodio (NaCl).
- Il legame metallico si caratterizza per ioni positivi immersi in un "mare" di elettroni liberi che stabilizza il reticolo cristallino.
Tutte le sostanze, elementi o composti sono costituiti da atomi uniti tra di loro più o meno stabilmente.
Definiamo legame chimico l’iterazione che tiene un atomo unito ad un altro.
I legami sono classificati in:
- Legami primari, o interatomici, sono quelli che tengono insieme gli atomi di una stessa molecola o di un unico reticolo cristallino.
- Legami secondari, o intermolecolari, sono quelli che si formano tra atomi appartenenti a molecole differenti.
Sono primari i legami covalenti, ionici e metallici. Essi sono definiti, inoltre, forti poiché tengono gli atomi con una certa forza.
Sono secondari i legami dipolo-dipolo, a idrogeno e quelli tra molecole non polari. Essi sono deboli rispetto ai primari.
Un legame tra due atomi si forma solo se l’energia della molecola è inferiore a quella degli atomi isolati. Con la formazione dei legami, agli atomi viene data una quantità minima di energia potenziale.
La formazione dei legami avviene in modo del tutto spontaneo, al contrario della loro rottura.
L’energia di legame è la quantità di energia necessaria per rompere i legami di un certo tipo presenti in una mole di sostanza allo stato gassoso. Essa è misurata in kJ/mol.
Nel 1916 il chimico Lewis enunciò la regola dell’ottetto di stabilità: un atomo è stabile se possiede otto elettroni all’interno del proprio guscio elettronico. Per raggiungere questa situazione gli atomi possono:
- Cedere uno o più elettroni ad un altro atomo o acquistarne da esso. I due atomi si trasformano quindi in ioni di carica opposta che si attraggono. Tra di loro nasce un legame ionico.
- Condividere uno o più elettroni di valenza con un altro atomo. Tra questi atomi nasce un legame covalente per ogni coppia di elettroni che viene condivisa.
-
Gli elettroni condivisi nel legame covalente prendono il nome di elettroni di legame.
Per rappresentare gli elettroni di valenza coinvolti nella formazione dei legami si utilizza la notazione di Lewis o diagramma a punti. Gli elettroni sono rappresentati come dei punti intorno al simbolo dell’elemento a cui appartengono. Gli elettroni di valenza quando sono più di 4, vengono rappresentati a coppie. Essi rappresentano i doppietti elettronici presenti orbitali completi.
Il legame covalente è il legame più diffuso in natura soprattutto nei gas e nei liquidi. Esso si forma quando due atomi mettono in comune una o più coppie di elettroni di valenza. (coppie di legame).
Esso può essere: puro, polare e dativo.
Il legame può essere rappresentato con una formula di struttura in cui il trattino tra i due simboli rappresenta la coppia di elettroni di legame.
Es. CLORO Cl
[img]http://ts1.mm.bing.net/th?id=HN.608030832438348912&pid=15.1&P=0[/img]
Gli elettroni che non partecipano al legame sono chiamati coppie libere. Gli atomi che si legano tra loro condividono una sola coppia di elettroni quindi creano un legame semplice.
Definiamo ordine di legame il numero di doppietti elettronici in comune. Nel caso base l’ordine di legame h valore 1.
Se tra due molecole abbiamo una zona ad elevata concentrazione di carica negativa tra i due nuclei non si avrà una grande stabilità. Per questo motivo, per creare una molecola stabile, bisogna utilizzare legami multipli.
Es: Ossigeno O2
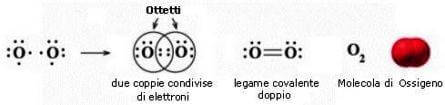
In questo caso abbiamo un doppio legame con ordine di legame 2: nella molecola abbiamo quindi due coppie di legame e quattro coppie libere.
Es: Azoto N2
In quest’altro caso abbiamo un triplo legame con ordine di legame 3: nella molecola abbiamo quindi tre coppie di legame e due coppie libere.
Il legame covalente puro (o covalente omeopolare) si realizza tra atomi dello stesso elemento con uguale elettronegatività o valori di elettronegatività molto vicini. Il caso più comune è H2 Cl2 Br2 i cui atomi sono uguali ed hanno una differenza di elettronegatività nulla. Questo legame produce una molecola non polare in cui la nuvola elettronica si distribuisce equamente su tutti i nuclei.
Il legame covalente polare (o covalente eteropolare) si realizza tra atomi di elementi diversi (ma i due atomi devono avere una differenza di elettronegatività inferiore a 1,9). Tale legame produce una nuvola molecola polare con una nuvola elettronica sull’atomo più elettronegativo che attira a sé gli elettroni.
La molecola si comporta come un dipolo elettrico ossia come un sistema contenente cariche opposte poiché l’atomo più elettronegativo tende a caricarsi negativamente mentre quello meno elettronegativo positivamente. I due eccessi di carica vengono chiamati cariche parziali e si indicano col simbolo δ- e δ+ posizionati sopra i simboli degli atomi.
La sua polarità più o meno accentuata di una molecola è espressa dal suo momento dipolare che in una molecola biatomica dipende dall’intensità delle due cariche parziali e si rappresenta con una freccia orientata da δ+ a δ- .
Il legame covalente dativo ha una coppia di elettroni in compartecipazione che proviene da un solo atomo chiamato donatore mentre il secondo, l’accettore, mette a disposizione un orbitale vuoto in cui gli elettroni possano muoversi.
Questo tipo di legame si crea tra due atomi di elementi diversi. In questo caso è chiamato legame di coordinazione. Il legame covalente dativo viene rappresentato con una freccia che parte dall'atomo datore D e arriva all'atomo accettore A. D → A
L'atomo accettore deve essere più elettronegativo dell'atomo datore.
Un esempio può essere lo ione ammonio NH+4 che si origina per coordinazione da parte dell’ammoniaca NH3 di uno ione positivo H+.
Il legame di coordinazione è indicato da una freccia che punta dal donatore all’accettore.
Anche le molecole di acqua possono coordinare uno ione idrogeno. Si forma lo ione H3O+ detto ione ossonio o idronio. Esso è all’origine dell’acidità delle soluzioni.
Esistono anche i composti di coordinazione in cui il legame di coordinazione è tra un atomo donatore ed uno ione metallico accettore. Alcuni dei composti dotati di un atomo donatore sono importanti in biologia come ad esempio il gruppo eme dell’emoglobina che trasporta uno ione di ferro.
Il legame ionico ideale tra due atomi consiste nel trasferimento di uno o più elettroni dall’atomo meno elettronegativo e quello più elettronegativo. Così il primo di trasforma in ione positivo, il secondo in ione negativo. Entrambi avranno una configurazione elettronica stabile (ottetto di stabilità) e tra essi si stabiliscono forze elettriche attrattive.
Quindi il legame ionico si origina tra uno ione positivo ed uno negativo. Tra di essi deve esserci una differenza di elettronegatività superiore a 1,9.
L’esempio più noto di un legame ionico è il cloruro di sodio NaCl. Il sodio appartiene al gruppo dei metalli alcalini ed ha un’elettronegatività uguale a 0,9 mentre il cloro è un alogeno ed ha un’elettronegatività pari a 3,0. Quindi il legame può esistere dato che la differenza di elettronegatività è pari a 2,1 > 1,9.
Trasformandosi nello ione Na+, il sodio assume la configurazione del neon mentre l’altro, trasformandosi in Cl- assume la configurazione dell’argo.
I composti ionici sono tutti soliti cristallini poiché ogni ione positivo si circone di ioni negativi e viceversa. Quindi nasce una struttura chiamata reticolo cristallino. Nel caso del cloruro di sodio ogni ione Na+ è circondato da sei ioni Cl- e allo stesso modo uno ione di Cl- è circondato da Na+.
I metalli dei gruppi I A,II A e III A e quelli di transizione che si trovano allo stato elementare formano reticoli cristallini senza legami ionici a causa della mancanza di ioni con segno opposto e di legami covalenti.
Gli atomi metallici a causa della loro bassa energia di ionizzazione si trasformano in ioni positivi perdendo i loro elettroni esterni. Questi sono quindi liberi di muoversi in tutto il cristallo creando uno schermo tra i nuclei che ne impedisce la reciproca repulsione.
Il legame metallico si forma alla presenta di ioni positivi immersi in un mare di elettroni liberi di muoversi in tutto il reticolo cristallino.
Domande da interrogazione
- Quali sono le principali tipologie di legami chimici e come si differenziano?
- Come si forma un legame covalente e quali sono le sue varianti?
- Cosa stabilisce la regola dell'ottetto di Lewis e come influenza la formazione dei legami?
- In che modo si rappresentano gli elettroni di valenza nei legami chimici?
- Qual è la differenza tra un legame ionico e un legame metallico?
I legami chimici si dividono in legami primari (covalenti, ionici e metallici) e legami secondari (dipolo-dipolo, a idrogeno e tra molecole non polari). I legami primari sono più forti e tengono insieme gli atomi di una molecola o di un reticolo cristallino, mentre i legami secondari sono più deboli e si formano tra molecole differenti.
Un legame covalente si forma quando due atomi condividono una o più coppie di elettroni di valenza. Può essere puro (omeopolare), polare (eteropolare) o dativo, a seconda della differenza di elettronegatività tra gli atomi coinvolti.
La regola dell'ottetto di Lewis afferma che un atomo è stabile se possiede otto elettroni nel suo guscio elettronico. Gli atomi possono raggiungere questa configurazione cedendo, acquistando o condividendo elettroni, formando rispettivamente legami ionici o covalenti.
Gli elettroni di valenza coinvolti nei legami chimici si rappresentano con la notazione di Lewis o diagramma a punti, dove i punti intorno al simbolo dell'elemento indicano gli elettroni. Le coppie di elettroni condivise sono rappresentate da trattini tra i simboli degli elementi.
Un legame ionico si forma tra ioni di carica opposta con una differenza di elettronegatività superiore a 1,9, come nel cloruro di sodio. Un legame metallico, invece, si forma tra ioni metallici positivi immersi in un mare di elettroni liberi, tipico dei metalli allo stato elementare.








 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo