Concetti Chiave
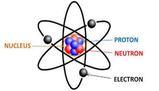
- L'atomo è costituito da protoni, neutroni ed elettroni, con il nucleo composto da protoni e neutroni e gli elettroni che esistono attorno a esso.
- Il modello atomico di Thomson suggerisce che la carica positiva occupa l'intero volume dell'atomo, con gli elettroni dispersi regolarmente al suo interno.
- Rutherford, attraverso esperimenti con particelle alfa, ha dimostrato che l'atomo contiene un nucleo centrale denso, circondato da elettroni nello spazio vuoto.
- Il nucleo dell'atomo è molto più piccolo del suo diametro complessivo, e la massa e la carica positiva dell'atomo sono concentrate nel nucleo.
- Il numero atomico di un atomo corrisponde al numero di protoni nel nucleo e, in un atomo neutro, è uguale al numero di elettroni.
Atomo - Generalità
L’atomo è formato da: protoni, neutroni ed elettroni, ovvero particelle submicroscopiche. L’elettrone (e-) ha una carica negativa (-1,602 x 10-19 C), ed ha una massa pari a 9,109 x 10-31kg. Il protone (e+) ha una carica positiva (-1,602 x 10-19 C), ed una massa 1836 volte maggiore di quella dell’elettrone. Il neutrone è una particella submicroscopica priva di carica elettrica con una massa 1839 maggiore dell’elettrone. Nonostante neutroni e protoni siano particelle submicroscopiche, non sono particelle elementari: sono a loro volta composti dai quark. Ogni atomo contiene un nucleo formato da neutroni e protoni, e gli elettroni esistono attorno a questo nucleo - è errato dire che elettroni ruotano in orbita al nucleo -; il nucleo è una zona molto piccola e densa composta dai nucleoni - neutroni e protoni -.
Modelli atomici di Thomson e Rutherford
Secondo Thomson la carica positiva occupava tutto il volume dell’atomo, gli elettroni invece sono dispersi in modo regolare. Qualche anno dopo, con gli studi sulla radioattività si capisce che gli atomi sono bersagli, e le particelle radioattive i proiettili. Rutherford, invece, condusse degli studi sulle radiazioni emesse dall’uranio che permettevano di determinare la natura delle particelle alfa (α), nuclei positivi di elio. Rutherford utilizza le particelle α sono proiettilo ideali per bombardare gli atomi di un foglio d’oro - il foglio aveva uno spessore di 0,01 mm -; i risultati dell’esperimento dimostrano che: la maggior parte delle particelle α attraversa la lamina senza subire deviazioni, alcune particelle, invece, vengono deviate, 1/20000 di particelle sono respinte all’indietro e con violenza, come se avessero colpito un corpo molto denso, e carico positivamente. Rutherford concluse che:- l’atomo è composto da un nucleo centrale in cui è concentrata la massa dell’atomo e la carica positiva
- gli elettroni occupano lo spazio vuoto attorno al nucleo
- il diametro del nucleo è 100.000 volte più piccolo del diametro dell’atomo.
- gli elettroni esistono attorno al nucleo, e sono in un numero tale da riuscire a bilanciare esattamente la carica positiva del nucleo.
Il numero atomico
Conoscendo che i nucleoni occupano uno spazio enormemente ridotto rispetto al volume complessivo dell’atomo, e che l’atomo ha una struttura vuota nella quale esistono gli elettroni: il numero di protoni presenti nel nucleo di un atomo, si chiama numero atomico, ma se l’atomo è neutro, allora questo numero è uguale a quello degli elettroni.Domande da interrogazione
- Quali sono le particelle submicroscopiche che compongono un atomo?
- Qual è la differenza principale tra i modelli atomici di Thomson e Rutherford?
- Cosa dimostrò l'esperimento di Rutherford con le particelle alfa?
- Cosa rappresenta il numero atomico in un atomo neutro?
L'atomo è composto da protoni, neutroni ed elettroni, che sono particelle submicroscopiche.
Thomson ipotizzava che la carica positiva occupasse tutto il volume dell'atomo con gli elettroni dispersi, mentre Rutherford dimostrò che la massa e la carica positiva sono concentrate in un nucleo centrale.
L'esperimento dimostrò che la maggior parte delle particelle alfa attraversa la lamina d'oro senza deviazioni, alcune vengono deviate, e poche sono respinte, indicando un nucleo denso e carico positivamente.
Il numero atomico rappresenta il numero di protoni nel nucleo di un atomo, ed è uguale al numero di elettroni in un atomo neutro.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo