Concetti Chiave
- Joseph John Thomson proposed the "plum pudding" model, suggesting atoms consist of negatively charged electrons within a positively charged "dough."
- Thomson's model indicated that atoms are neutral, as negative charges neutralize positive charges, redefining atoms as divisible entities.
- Ernest Rutherford disproved Thomson's model, establishing the nuclear model where a dense, positively charged nucleus is orbited by electrons.
- Rutherford's gold foil experiment revealed that atoms are mostly empty space with a concentrated positive charge at the center.
- Rutherford's model faced critique for contradicting classical physics, which predicted that orbiting electrons would lose energy and collapse into the nucleus.
MODELLO ATOMICO DI THOMSON
Joseph John Thomson è stato un fisico britannico che nel 1896 dimostrò, attraverso una serie di esperimenti, che i raggi catodici erano costituiti da piccole particelle cariche negativamente che egli chiamava 'corpuscoli'. Thomson ne definì la massa e la carica e solo successivamente questi 'corpuscoli' furono chiamati elettroni.
Subito dopo la scoperta dell'elettrone, Thomson, nel 1904, propose un modello atomico che fu definito modello a panettone in cui l'atomo veniva rappresentato come una distribuzione di carica positiva diffusa, contenente delle cariche negative disposte in maniera regolare, in anelli rotanti. Se consideriamo un panettone, i canditi rappresentano gli elettroni immersi in una pasta carica positivamente.

Questo modello propone quindi che le cariche negative siano in grado di neutralizzare la presenza delle cariche positive in cui sono immerse, stabilendo che l'atomo è neutro.
Thomson, così, rappresenta l'atomo non più come qualcosa di indivisibile, ma piuttosto come qualcosa di divisibile, in quanto costituito da particelle subatomiche, più piccole dell'atomo stesso.
Ernest Rutherford, chimico e fisico britannico, fece un esperimento che culminò con la confutazione del modello atomico a panettone proposto da Thomson. Egli dimostrò che l'atomo era costituito da un nucleo centrale in cui si concentrava la maggior parte della materia carica positivamente (nucleo atomico), intorno al quale ruotavano gli elettroni. Quindi, a differenza del modello atomico di Thomson in cui l'atomo è rappresentato come una sfera carica positivamente, in cui sono immersi gli elettroni, il modello atomico planetario di Rutherford propone un atomo 'vuoto' che concentra tutta la materia carica positivamente in un nucleo delimitato, attorno al quale ruotano gli elettroni.

ESPERIMENTO DI RUTHERFORD
L'esperimento di Rutherford aveva come scopo quello di confermare il modello atomico proposto da Thomson.
Questo esperimento prevedeva l'utilizzo di una sorgente radioattiva in grado di emettere particelle alfa che venivano sparate su una lamina d'oro.
Quello che ci si aspettava era che le particelle alfa, una volta entrate in contatto con la lamina d'oro, la attraversassero parallelamente o al più venissero leggermente deviate tutte allo stesso modo, data l'omogeneità dell'atomo. Quello che si osservò, invece, era che alcune particelle venivano deviate anche con angoli maggiori di 90°, tornando verso la fonte che le aveva generate.
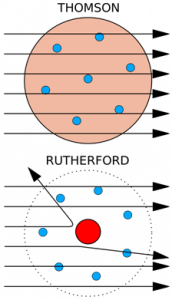
L'ipotesi di Rutherford fu che l'atomo doveva essere costituito da una zona centrale di materia estremamente densa nonché carica, in grado di interrompere il decorso delle grandi particelle alfa, e addirittura in grado di farle rimbalzare.
Grazie a questo esperimento Rutherford è giunto alla conclusione che al centro dell'atomo vi fosse un nucleo denso e carico positivamente, che intorno ad esso ruotassero elettroni carichi negativamente in numero tale da neutralizzare la carica positiva e che tra il nucleo e gli elettroni ci fosse spazio vuoto.
Questo modello non fu accettato completamente dalla comunità scientifica in quanto entrava in contrasto con la fisica classica secondo cui una particella carica accelerata emette energia sotto forma di radiazione elettromagnetica, perdendo energia. Gli elettroni che ruotano attorno al nucleo centrale perderebbero energia fino ad annichilire, ossia a collassare sul nucleo.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] - Orbitali molecolari
- Legami chimici [4] - Legame covalente polare e dativo
- Legami chimici [5] - Legame ionico
- Legami chimici [6] - Legame metallico]
Domande da interrogazione
- Qual è stato il contributo principale di Joseph John Thomson alla fisica?
- In cosa consiste il modello atomico a panettone di Thomson?
- Come ha confutato Ernest Rutherford il modello atomico di Thomson?
- Quali furono le osservazioni chiave dell'esperimento di Rutherford?
- Perché il modello atomico di Rutherford non fu completamente accettato dalla comunità scientifica?
Joseph John Thomson ha dimostrato che i raggi catodici erano costituiti da particelle cariche negativamente chiamate 'corpuscoli', successivamente noti come elettroni, e ha proposto il modello atomico a panettone.
Il modello a panettone di Thomson rappresenta l'atomo come una distribuzione di carica positiva diffusa con elettroni disposti in anelli rotanti, simili a canditi in un panettone, neutralizzando la carica positiva.
Rutherford ha confutato il modello di Thomson dimostrando che l'atomo ha un nucleo centrale denso e carico positivamente, attorno al quale ruotano gli elettroni, attraverso il suo esperimento con particelle alfa e una lamina d'oro.
L'esperimento di Rutherford ha mostrato che alcune particelle alfa venivano deviate con angoli maggiori di 90°, suggerendo la presenza di un nucleo denso e carico positivamente che respingeva le particelle.
Il modello di Rutherford non fu completamente accettato perché contraddiceva la fisica classica, secondo cui una particella carica accelerata emette energia, portando gli elettroni a perdere energia e collassare sul nucleo.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo