Concetti Chiave
- La configurazione elettronica descrive come gli elettroni sono distribuiti negli orbitali di un atomo.
- Gli orbitali sono spazi dove gli elettroni si muovono, contenendo massimo due elettroni con spin opposto.
- Il riempimento degli orbitali parte dal livello energetico più basso, seguendo un ordine specifico.
- I sottolivelli s, p, d, e f hanno capacità massime rispettivamente di 2, 6, 10, e 14 elettroni.
- Per i sottolivelli p, d, e f, si inserisce prima un elettrone in ogni orbitale, poi si aggiungono i secondi elettroni.
La configurazione elettronica
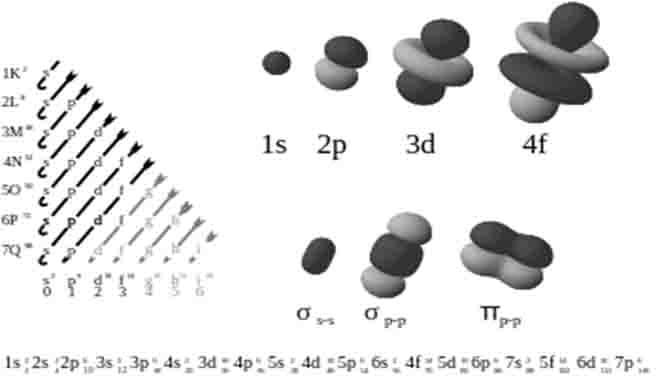
Per configurazione elettronica degli elementi si indica la disposizione degli elettroni negli orbitali, sottolivelli e livelli energetici di un atomo.
L'orbitale è lo spazio in cui girano gli elettroni; in ognuno di essi al massimo ci possono essere al massimo due elettroni con spin opposto.
Il riempimento inizia dal livello più basso di energia.
Ci sono quattro tipi di sottolivelli:
S= dove al massimo ci possono stare due elettroni.
p= dove al massimo ci stanno sei elettroni.
d= dove al massimo ci stanno dieci elettroni.
f= dove al massimo ci stanno quattordici elettroni.
I sottolivelli p d ed f dono isoenergetici,cioè che devono essere riempiti inserendo prima un solo elettrone per orbitale e dopo aver occupato con un elettrone tutti gli orbitali si inserisce il secondo elettrone nell' orbitale.
Da quanto abbiamo detto possiamo ricavare queste regole:
°ogni orbitale non può contenere più di due elettroni;
°gli orbitali vengono riempiti dal livello più basso di energia;
°il riempimento degli orbitali p,d,f si riempono prima inserendo un solo elettrone con spin uguale in tutti gli orbitali e poi si comincia a riempire con gli altri elettroni;
L' ordine del riempimento degli orbitali sarà quindi :
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo