Visione di insieme del ciclo di Krebs
Innanzitutto, l'acetil-CoA entra nel ciclo e si condensa con l'ossalacetato (presente ad una concentrazione di 10 M) attraverso una condensazione di Claisen (reazione tra un estere ed un composto carbonilico). Questa reazione è possibile grazie alla presenza dell'enzima citrato sintasi (o sintetasi). Praticamente il gruppo metilico, trasformato dall'enzima in gruppo metilenico, in un carbanione molto reattivo per l'attacco nucleofilo, si attacca al C=O carbonilico dell'ossalacetato per formare citrato che è un acido tricarbossilico (acido 2 idrossi- 1,2,3-propantricarbossilico).
Il citrato appena formato, grazie all'azione della aconitasi, va incontro ad una reazione di deidratazione e reidratazione per spostare l'ossidrile dal carbonio 2 al 3. La reazione è all'equilibrio e serve per preparare il composto alla reazione successiva, ovvero quella di decarbossilazione ossidativa.
cui interviene l'isocitratodeidrogenasi. In questo modo da un composto a sei carboni se ne forma uno acinque, l'alpha-chetoglutarato. Grazie all'ossidazione del gruppo alcolico-secondario che si era formato gli elettroni vengono trasferiti come ioni H al NAD+ performare NADH.
L'alpha-chetoglutarato subisce immediatamente la seconda decarbossilazioneossidativa e si forma nuovamente NADH, grazie all'intervento del complesso alpha-chetoglutarato deidrogenasi, molto simile alla piruvato deidrogenasi. Questa reazione porta alla formazione di succinil-CoA.
Abbiamo già ottenuto un composto con lo stesso numero di carboni dell'ossalacetato finale che dobbiamo risintetizzare.
Il succinil-CoA cede parte dell'energia contenuta nel legame tioestere per sintetizzare GTP da GDP o ATP da ADP a seconda degli isoenzimi (fosforilazione a livello del substrato) nella reazione catalizzata dalla succinil-CoA sintetasi. Si forma acidosuccinico, un acido
simmetrico per cui non sono più distinguibili i carboni dell'acetile. Nella terzultima reazione si procede alla deidrogenazione del succinato in modo che si formi fumarato, in una reazione stereospecifica. Gli elettroni questa volta vanno al FAD, legato alla succinato deidrogenasi, che viene di conseguenza ridotto a FADH2. Questo è l'unico enzima del ciclo di Krebs che si trova attaccato alla membrana mitocondriale interna e che fa parte della catena respiratoria mitocondriale. Con la deidrogenazione si forma un doppio legame, quindi un acido bicarbossilico insaturo (fumarato). Il fumarato poi, ad opera della fumarasi, con l'introduzione di una molecola d'acqua forma il malato, un idrossiacido bicarbossilico. Quest'ultimo, ad opera della malato deidrogenasi, viene trasformato in ossalacetato producendo l'ultimo NADH del ciclo. Complessivamente vengono liberati otto elettroni per ogni acetil-CoA. Le ultime tre reazioni del ciclo di Krebs ricordanoLa beta-ossidazione avviene sempre all'interno dei mitocondri. Questo ciclo rallenta se la cellula è in condizioni di energia abbondante e avviene in modo molto rapido se necessita di ricaricarsi.
REAZIONE 1: FORMAZIONE DEL CITRATO
La citrato sintasi è un enzima omodimerico formato da due monomeri uguali e catalizza una reazione irreversibile. L'acetil-CoA si condensa con l'ossalacetato formando un intermedio, il citril-CoA.

Meccanismo: grazie all'intervento dell'aspartato posto in posizione 375 e dell'istidina in posizione 274, si ha la formazione di un intermedio enolico. Si ha poi l'attacco da parte dell'enolato del gruppo carbonilico dell'ossalacetato. A questo punto avviene l'idrolisi del tioestere, viene liberato il CoA-SH e si forma il citrato.
proprio l'idrolisi del tioestere che rende la reazione irreversibile (ΔG = -7,3 Kcal/mole = -32,2KJ/mole).1 il doppio legame può subire l'addizione di acqua formando un alcool secondario 3Questo è un classico esempio di condensazione di Claisen, una reazione che avviene tra due esteri oppure tra un estere ed un composto carbonilico. In questo caso i protagonisti sono un tioestere (acetil- CoA) ed un composto carbonilico (ossalacetato).I due monomeri uguali dell'enzima si uniscono nel sito attivo, entra prima l'ossalacetato preparando l'enzima ad accogliere meglio l'acetil-CoA. I ricercatori l'hanno scoperto utilizzando un analogo, il carbossimetil-CoA, un intermedio stabile in grado di bloccare la reazione. È stato visto che entra prima l'ossalacetato, questo induce una modifica conformazionale per far entrare l'acetil-CoA (esempio di adattamento indotto come per l'esochinasi). La condensazione di Claisen
sfrutta reazioni acido-base che avvengono nel sito catalitico.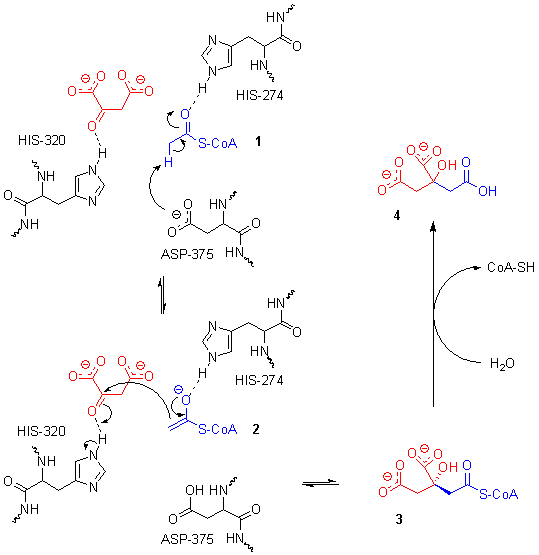 Grazie all'istidina 320 del sito catalitico che compie una catalisi acida viene protonato il carbonio carbonilico. In questo modo subisce meglio l'attacco nucleofilo da parte del 4 carbonio metilico dell'acetil-CoA. A sua volta il gruppo metilico dell'acetil-CoA è reso più nucleofilo da una catalisi basica dell'aspartato in posizione 375, il quale prende un idrogeno del gruppo metilico, diventando metilenico. Il carbonio si trasforma in un carbanione, un potente nucleofilo. Si forma l'intermedio citril-CoA che viene successivamente idrolizzato, rendendo la reazione esoergonica, e si forma il citrato.
Vi è un meccanismo più complesso che prevede l'intervento di un'altra istidina 274 e la formazione di un intermedio enolico.
Curiosità: il ciclo di Krebs può essere
Grazie all'istidina 320 del sito catalitico che compie una catalisi acida viene protonato il carbonio carbonilico. In questo modo subisce meglio l'attacco nucleofilo da parte del 4 carbonio metilico dell'acetil-CoA. A sua volta il gruppo metilico dell'acetil-CoA è reso più nucleofilo da una catalisi basica dell'aspartato in posizione 375, il quale prende un idrogeno del gruppo metilico, diventando metilenico. Il carbonio si trasforma in un carbanione, un potente nucleofilo. Si forma l'intermedio citril-CoA che viene successivamente idrolizzato, rendendo la reazione esoergonica, e si forma il citrato.
Vi è un meccanismo più complesso che prevede l'intervento di un'altra istidina 274 e la formazione di un intermedio enolico.
Curiosità: il ciclo di Krebs può essere“avvelenato” utilizzando un composto apparentemente innocuo, il Fluoroacetato. esso è attivato in Fluoroacetil-CoAdall’acetil-CoA sintetasi. Il Fluoroacetato è un composto naturale trovato in una pianta sudafricana e successivamente utilizzato anche a scopo bellico, estratto dalla pianta o sintetizzato ex novo dai chimici tedeschi.
Il Fluoroacetil-CoA inganna la citrato sintasi e viene trasformato in Fluorocitrato. Successivamente questo composto si lega covalentemente alla aconitasi, bloccando il ciclo e provocando morte cellulare. Esso è definito “inibitore Cavallo di Troia” perché entra in modo innocente a livello della citrato sintasi, ma poi inibisce l’enzima successivo.
REAZIONE 2: FORMAZIONE DELL’ISOCITRATO
Vi è una prima reazione di deidratazione in cui si forma cis-aconitato seguita da una reidratazione in posizione diversa. In sostanza è un riarrangiamento intramolecolare enzimatico dove l’OH in
posizione 2 va in posizione più esterna (3 o 1) con formazione01dell’isocitrato. La reazione è all’equilibrio (ΔG =-13,3 KJ/mole). L’enzima contiene deicentri Fe-S molto presenti nella catena respiratoria. Questi centri Fe-S scambiano un2+ 3+elettrone per volta perché il Fe passa da Fe a Fe e viceversa. Nel sito attivo vi è siaaggiunta che rimozione di acqua. È una reazione preparatoria alla successiva operatainvece dalla isocitrato deidrogenasi.

REAZIONE 3: OSSIDAZIONE DELL’ISOCITRATO AD α-CHETOGLUTARATO E CO2

La reazione successiva è catalizzata dallaisocitrato idrogenasi. È unadecarbossilazione
ossidativa doveinizialmente abbiamo una ossidazione (dueidrogeni vanno al NAD+ o al NADP+ a secondadell’isoenzima). Quindi l’accettore può essereNAD o NADP che vengono ridotti a NADH oNADPH. Esiste infatti una isocitratodeidrogenasi citoplasmatica che serve agenerare NADPH.
Uno ione Mn interagisce con il gruppocarbonilico presente nell’ossalosuccinato, chesi forma transitoriamente e non lascia il suosito di legame fino alla sua conversione in α-chetoglutarato mediante decarbossilazione.
L’Mn stabilizza anche l’enolo formatotransitoriamente per decarbossilazione.
Questo enzima opera prima con deidrogenazione (ossidazione) e dopo concarbossilazione, lavora quindi al contrario rispetto alla piruvato deidrogenasi che primaopera una decarbossilazione e poi una deidrogenazione. L’enzima catalizzante lareazione completa è l’isocitrato deidrogenasi, NAD o NADP dipendente, esce CO2ed è inibito dalle forme cariche, ovvero ATP.
E NADH, mentre chiaramente ADP e NAD+lo attivano (nel muscolo intervengono anche gli ioni calcio). È una reazione esoergonica, come quella della citrato sintasi, ha un ΔG = -5kcal/mol = -20kj/mol.
La seconda reazione del ciclo è sicuramente esoergonica. Breve ricapitolo delle prime tre reazioni:
- Condensazione di Claisen;
- Deidratazione e reidratazione (operata dalla aconitasi);
- Decarbossilazione ossidativa (operata dall'isocitrato deidrogenasi).
E abbiamo fin qua formato il primo NADH.
Regolazione dell'isocitrato deidrogenasi: le forme cariche ATP e NADH lo inibiscono, mentre le forme scariche ADP, NAD+ e, soprattutto nel muscolo, gli ioni calcio lo attivano. Del resto, è una regolazione comune a molti altri enzimi che sono appunto regolati in questo modo. Pare che sia proprio l'inibizione dell'isocitrato deidrogenasi (e non della citrato sintasi) che farebbe sì che l'acido citrico si accumuli nei mitocondri e poi
fuoriesca, ovviamente in condizioni di buon contenuto energetico. L'ATP e il NADH che si accumulano inibiscono l'isocitrato deidrogenasi, il citrato si accumula, fuoriesce dal mitocondrio tramite un trasportatore e in queste condizioni di ricchezza energetica, soprattutto nel fegato, il citrato va ad inibire la PFK1 lipolitica e poi diventa fornitore di acetil-coA per la sintesi di acidi grassi e colesterolo. Questo diventa substrato della citrato liasi che lo scinde in ossalacetato e acetil-CoA. L'ossalacetato poi torna dentro sotto forma di malato (dato che l'ossalacetato non ha un trasportatore mentre il malato sì). In queste condizioni gran parte del malato diventa substrato dell'enzima malico. L'enzima malico riduce NADP a NADPH, fondamentale per le sintesi riduttive. Si forma piruvato che può andare dentro al mitocondrio perché ha un suo trasportatore.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo