Concetti Chiave
- Dimitrij Mendeleev ideò la tavola periodica ordinando gli elementi in base al peso atomico, lasciando spazi per elementi non ancora scoperti.
- Gli elementi sono disposti in 7 periodi orizzontali e 8 gruppi verticali, con il gruppo 0 composto dai gas nobili.
- Gli elementi di transizione sono situati tra il II e il III gruppo e hanno elettroni nel guscio più esterno.
- I colori nella tavola periodica distinguono metalli, semi metalli, non metalli e gas nobili, ognuno con proprietà specifiche.
- Le proprietà chimiche degli elementi dipendono dal numero di elettroni nel guscio esterno, influenzando la loro reattività.
Indice
Origini della tavola periodica
In questo appunto viene spiegata la tavola periodica, la disposizione e la suddivisione degli elementi della cosiddetta tavola periodica.
Verso la fine del 1800 il chimico russo Dimitrij Mendeleev raccolse tutti gli elementi allora conosciuti in una tabella chiama tavola periodica, ordinandoli dal più leggero al più pesante. Ogni elemento sulla tavola periodica è riportato in modo preciso: è riportato il simbolo chimico, il numero atomico, il peso atomico e altre caratteristiche legate a quel determinato elemento. Mendeleev mise in ordine 56 elementi conosciuti al suo tempo in base al numero atomico corrispondente. Già lo scienziato russo pensava che gli elementi fossero molti di più rispetto a quelli che aveva scoperto perché nella tavola periodica che costruì erano presenti degli spazi vuoti riservati a tutti quegli elementi che dovevano ancora essere scoperti e studiati. Al giorno d'oggi la tavola periodica è più completa di quella che ideò lo scienziato Mendeleev e gli elementi sono disposti in ordine crescente secondo il numero atomico che indica il numero di elettroni e di protoni.
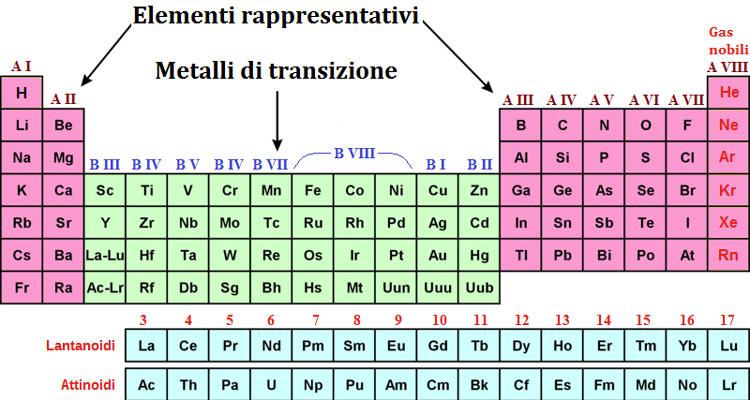
Struttura della tavola periodica
Gli elementi nella tavola periodica sono elencati in ordine crescente per peso atomico e poi sono disposti in 7 righe orizzontali chiamate “periodi”. Il primo periodo comprende solo due elementi, l'idrogeno (H) e l'elio (He); il secondo e il terzo 8 elementi; il quarto e il quinto 18 elementi; il sesto e il settimo comprendono anche tutti quegli elementi posizionati nella parte sottostante della tavola periodica.
Nella tavola periodica sono presenti 8 colonne chiamate anche “gruppi” riconoscibili dai numeri romani che vanno dal I a VII più il gruppo chiamato 0 (zero), i cui elementi vengono chiamati “gas nobili” perché non si uniscono a nessun elemento e quindi non andranno a formare nessun composto. Gli elementi che fanno parte di uno specifico gruppo, nel guscio più esterno presentano lo stesso numero di elettroni che deve essere uguale al numero di protoni (es. Litio, sodio, potassio, rubidio, cesio e francio ne avranno 1; mentre berillio magnesio calcio, stronzio, bario e radio ne avranno due e così via), fino ad arrivare a quegli elementi che ne hanno 8 e ciò rappresenta il massimo numero di elementi che possono essere contenuti all’interno di un guscio elettronico.
Caratteristiche degli elementi
Gli elementi di transizione sono tutti quegli elementi che sono posti nella parte centrale della tavola periodica tra il II e il III gruppo degli elementi. Questi non fanno parte di veri e propri gruppi e per questo sono detti di “transizione”. Anche questi elementi avranno degli elettroni nel guscio più esterno.
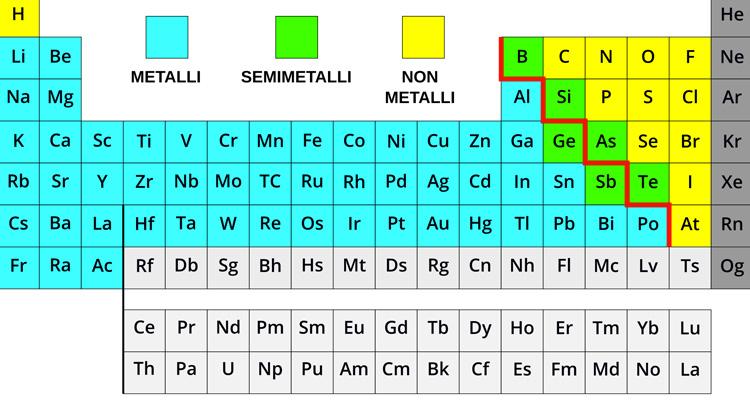
La tavola periodica degli elementi è caratterizzata da differenti colori attribuiti ad alcuni elementi. La funzione dei colori è quella di distinguere le categorie più importanti nelle quali sono suddivisi gli elementi, ovvero in metalli, semi metalli, non metalli e gas nobili.
I metalli sono quelli che vanno dal litio al berillio, tutti gli elementi di transizione. Hanno la caratteristica di essere plastici, ovvero si possono flettere e modificare in modo permanente, sono buoni conduttori del calore e dell'elettricità. Tutti i metalli del I gruppo, presentano un solo elettrone che conferisce all’elemento una forte reattività. I metalli del II gruppo, hanno due elettroni esterni debolmente trattenuti dal nucleo e sono meno reattivi dei metalli del I gruppo. Gli elementi di questo gruppo tendono a perdere facilmente gli elementi esterni per formare ioni stabili e con l’acqua formano degli idrossidi. Poi ci sono i non metalli come il carbonio, l’azoto, l’ossigeno. Essi mostrano proprietà inverse rispetto a quelle possedute dai metalli: i non metalli sono opachi, friabili, se si tenta di piegarli si rompono, sono pessimi conduttori di elettricità e di calore. Quindi ciò che li distingue è proprio la conducibilità elettrica e le proprietà acido-basiche degli ossidi. Infine, l’ultima colonna è occupata dai gas nobili. Essi presentano un solo atomo, non hanno colore né odore e sapore. Gli atomi dei gas hanno una forma sferica e non sono polari, di conseguenza hanno proprietà fisiche che cambiano in base al gruppo.
Proprietà chimiche e reattività
Le proprietà chimiche degli elementi della tavola periodica sono influenzate principalmente dal numero di elettroni posizionati nel guscio elettronico più esterno. Questo significa che meno elettroni hanno un elemento e più facile sarà la reazione e il legame con altri elementi per la formazione di molecole e composti. Ad esempio, il sodio (Na) che fa parte del primo gruppo e della prima colonna, ha un solo elettrone nel guscio più esterno. Questo elettrone di solito reagisce bene con il cloro che invece si trova nel settimo gruppo perché ha 7 elettroni nel guscio più esterno. Questi due elementi reagiscono tra loro per formare un composto molto comune, ovvero il sale da cucina. Questo avviene grazie al fatto che il sodio, avendo un solo elettrone e appartenendo al primo gruppo, facilmente si lega con altri elementi per la formazione di molecole e composti.
Domande da interrogazione
- Chi ha inventato la tavola periodica degli elementi?
- Come sono disposti gli elementi nella tavola periodica?
- Cosa sono gli elementi di transizione?
- Qual è la funzione dei colori nella tavola periodica?
- Come influenzano le proprietà chimiche degli elementi il numero di elettroni nel guscio esterno?
La tavola periodica degli elementi è stata inventata dal chimico russo Dimitrij Mendeleev verso la fine del 1800.
Gli elementi sono disposti in ordine crescente per peso atomico e suddivisi in 7 periodi orizzontali e 8 gruppi verticali.
Gli elementi di transizione sono quelli situati nella parte centrale della tavola periodica tra il II e il III gruppo e non appartengono a veri e propri gruppi.
I colori nella tavola periodica servono a distinguere le categorie principali degli elementi: metalli, semi metalli, non metalli e gas nobili.
Le proprietà chimiche sono influenzate dal numero di elettroni nel guscio esterno; meno elettroni ci sono, più facile è la reazione e il legame con altri elementi.






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo